题目内容
(14分)常见化学反应方程式A+B X+Y+H2O。请回答:
X+Y+H2O。请回答:
(1) 若A为易溶于水的盐,B是强碱,实验室常用此反应制备气体X,写出该反应的化学方程式 ,检查其中气体X的方法是 。
(2) 若A为黑色固体,Y是黄绿色气体,写出Y 的电子式 ,该反应的离子方程式是 。将气体Y通入NaOH溶液中加热发生反应,当消耗6.72L(标准状况)Y气体时,转移0.5mol电子,写出该反应的化学方程式 。
(3) 若A为金属单质,B是稀硝酸,当A与B以物质的量之比为1:4进行反应,生成无色气体X,遇空气立即变为红棕色。且A可溶于Y溶液中。
①写出该反应的化学方程式 。
②含0.5molY的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量恰好相等,则被还原的Y是 mol。
 X+Y+H2O。请回答:
X+Y+H2O。请回答:(1) 若A为易溶于水的盐,B是强碱,实验室常用此反应制备气体X,写出该反应的化学方程式 ,检查其中气体X的方法是 。
(2) 若A为黑色固体,Y是黄绿色气体,写出Y 的电子式 ,该反应的离子方程式是 。将气体Y通入NaOH溶液中加热发生反应,当消耗6.72L(标准状况)Y气体时,转移0.5mol电子,写出该反应的化学方程式 。
(3) 若A为金属单质,B是稀硝酸,当A与B以物质的量之比为1:4进行反应,生成无色气体X,遇空气立即变为红棕色。且A可溶于Y溶液中。
①写出该反应的化学方程式 。
②含0.5molY的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量恰好相等,则被还原的Y是 mol。
(每空各2分)(1) 2NH4Cl+Ca(OH)2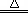 CaCl2+2H2O +2NH3↑;用湿润的红色石蕊试纸检验,若变蓝,则是NH3。或用蘸浓盐酸的玻璃棒检验,若冒白烟,则是NH3。
CaCl2+2H2O +2NH3↑;用湿润的红色石蕊试纸检验,若变蓝,则是NH3。或用蘸浓盐酸的玻璃棒检验,若冒白烟,则是NH3。
(2)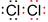 ;MnO2+4H++2Cl-
;MnO2+4H++2Cl-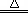 Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
6NaOH +3Cl2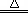 NaClO3+5NaCl+ 3H2O
NaClO3+5NaCl+ 3H2O
(3) ① Fe+4HNO3 NO↑+Fe(NO3)3+2H2O ② 0.2
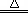 CaCl2+2H2O +2NH3↑;用湿润的红色石蕊试纸检验,若变蓝,则是NH3。或用蘸浓盐酸的玻璃棒检验,若冒白烟,则是NH3。
CaCl2+2H2O +2NH3↑;用湿润的红色石蕊试纸检验,若变蓝,则是NH3。或用蘸浓盐酸的玻璃棒检验,若冒白烟,则是NH3。(2)
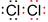 ;MnO2+4H++2Cl-
;MnO2+4H++2Cl-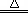 Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;6NaOH +3Cl2
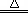 NaClO3+5NaCl+ 3H2O
NaClO3+5NaCl+ 3H2O(3) ① Fe+4HNO3
(1) 若A为易溶于水的盐,B是强碱,则该反应为复分解反应,生成另外一种盐和碱,且其中有一种气体,应该想到为氨气;检验氨气用湿润的红色石蕊试纸检验,若变蓝,则是NH3。或用蘸浓盐酸的玻璃棒检验,若冒白烟,则是NH3。
(2) 若A为黑色固体,Y是黄绿色气体,显然Y是氯气,实验室制氯气反应:MnO2+4H++2Cl-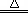 Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(3)生成无色气体X,遇空气立即变为红棕色,X为NO;且A可溶于Y溶液中,金属单质溶于金属的盐溶液中,该金属为变价金属,则为Fe。
(2) 若A为黑色固体,Y是黄绿色气体,显然Y是氯气,实验室制氯气反应:MnO2+4H++2Cl-
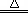 Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;(3)生成无色气体X,遇空气立即变为红棕色,X为NO;且A可溶于Y溶液中,金属单质溶于金属的盐溶液中,该金属为变价金属,则为Fe。

练习册系列答案
相关题目