题目内容
【题目】氮化铝(AlN)是一种性能优异的新型材料,在许多领域有广泛应用,前景广阔。某化学小组模拟工业制氮化铝原理欲在实验室制备氮化铝并检验其纯度。
查阅资料:①实验室用饱和NaNO2溶液与NH4C1溶液共热制N2:NaNO2+NH4Cl ![]()
![]() NaCl+N2↑+2H2O
NaCl+N2↑+2H2O
②工业制氮化铝:Al2O3+3C+N2 ![]() 2AlN+3CO,氮化铝在高温下能水解。
2AlN+3CO,氮化铝在高温下能水解。
③AlN与NaOH饱和溶液反应:AlN+NaOH+H2O= NaAlO2+NH3↑。
I.氮化铝的制备

(1)实验中使用的装置如上图所示,请按照氮气气流方向将各仪器接口连接:e→c→d→___(根据实验需要,上述装置可使用多次)。
(2)B装置内的X液体可能是____,E装置内氯化钯溶液的作用可能是_____。
Ⅱ.氮化铝纯度(含Al2O3、C杂质)的测定
(方案i)甲同学用下图装置测定AlN的纯度(部分夹持装置已略去),且不考虑NH3在NaOH浓溶液中的溶解。
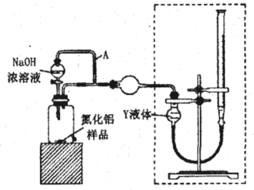
(3)为准确测定生成气体的体积,量气装置(虚线框内)中的Y液体可以是___。
a.CCl4 b.H2O c. NH4Cl饱和溶液 d. 植物油
(4)若装置中分液漏斗与导气管之间没有导管A连通,对所测AlN纯度的影响是____(填“偏大”“偏小”或“不变”)
(方案ii)乙同学认为上述方案不可行,设计以下步骤测定样品中AlN的纯度。
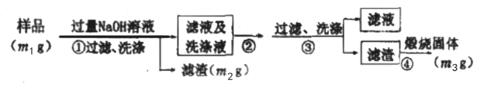
(5)步骤②通入过量_____(填化学式)气体。
(6)步骤③过滤所需要的主要玻璃仪器有______。
(7)样品中AlN的纯度是_____(用含m1、m2、m3的表达式表示)。
【答案】f(g) →g(f) →a→b→i(或f(g) →g(f) →c→d→i) 浓硫酸 吸收CO,防止污染 ad 偏大 CO2 玻璃棒、漏斗、烧杯 ![]()
【解析】
由题中信息可知,C装置用于制备氮气;B装置用于干燥氮气或用于保护氮化铝;D装置用于制备氮化铝;A装置用于保护氮化铝防止其水解;E装置用于尾气处理。可以通过测定样品与氢氧化钠溶液生成的氨气的体积,来确定样品的纯度,或将其转化为氧化铝,根据样品与氧化铝的质量差来测定样品的纯度。
(1)由分析可知,C装置制备的氮气经B装置干燥后通入D装置中与铝和碳粉在高温下发生反应可制备氮化铝,由于氮化铝在高温下容易发生水解,故要用A装置或B装置进行保护,尾气中含有污染大气的一氧化碳,故要用E装置进行处理,因此,按照氮气气流方向将各仪器接口连接:e→c→d→f(g) →g(f) →a→b→i(或e→c→d→f(g) →g(f) →c→d→i)。
(2)B装置用于干燥氮气,其中的X液体可能是浓硫酸,E装置内氯化钯溶液的作用可能是吸收CO,防止污染空气。
(3)为准确测定生成气体的体积,量气装置(虚线框内)中的Y液体不能溶解氨气,所给的几种液体中,H2O和NH4Cl饱和溶液可以溶解氨气,根据相似相溶原理可知,氨气不易溶于CCl4和植物油,故Y液体可以选ad。
(4)若装置中分液漏斗与导气管之间没有导管A连通,则所测的气体体积中包括了所加的氢氧化钠溶液排出的空气,导致所测氨气的体积偏大,所测AlN的纯度偏大。
(5)由实验流程可知,样品与过量的氢氧化钠溶液充分反应后,可以得到主要成分为C的滤渣,其质量为m1g;样品中的氮化铝和氧化铝均转化为偏铝酸钠进入滤液,向其中通入过量的二氧化碳后,偏铝酸钠转化为氢氧化铝沉淀,煅烧该沉淀得到氧化铝的质量为m3g。所以,步骤②通入过量CO2气体。
(6)步骤③过滤所需要的主要玻璃仪器有:玻璃棒、漏斗、烧杯。
(7)由上述分析可知,样品中氧化铝和氮化铝的质量为(m1-m2)g,最后得到氧化铝的质量为m3g,质量增大了m3g -(m1-m2)g=(![]() )g,这两个质量的变化是由氮化铝转化为氧化铝所引起的。由铝元素守恒可以得到关系式2AlN~Al2O3,即2mol氮化铝可以转化为1mol氧化铝,质量增大了20g,所以,样品中AlN的物质的量为
)g,这两个质量的变化是由氮化铝转化为氧化铝所引起的。由铝元素守恒可以得到关系式2AlN~Al2O3,即2mol氮化铝可以转化为1mol氧化铝,质量增大了20g,所以,样品中AlN的物质的量为![]() ,其质量为
,其质量为![]() ,则AlN的纯度是
,则AlN的纯度是![]() 。
。

【题目】已知25℃时,几种常见弱酸的Ka如下表所示:
电解质 | H2C2O4 | CH3COOH | HCN | H2CO3 |
电离常数(molL-1) | K1=5.6×10-2 K2=5.4×10-3 | K=1.7×10-5 | K=6.2×10-10 | K1=4.2×10-7 K2=5.6×10-11 |
(1)草酸(H2C2O4)是一种___(填“一元”、“二元”、“多元”)弱酸。25℃时,0.1molL-1的Na2C2O4、CH3COONa、NaCN、Na2CO3溶液的pH由大到小的顺序是__。
(2)KHC2O4溶液呈酸性,向10mL0.01molL-1的H2C2O4溶液滴加0.01molL-1KOH溶液V(mL)。回答下列问题:
①当V<10mL时,反应的离子方程式为___。
②当V=10mL时,溶液中![]() 、
、![]() 、H2C2O4、H+的浓度由大到小的顺序为__。
、H2C2O4、H+的浓度由大到小的顺序为__。
③当V=amL时,溶液中离子浓度有如下关系:c(K+)=2c(![]() )+c(
)+c(![]() );当V=bmL时,溶液中离子浓度有如下关系:c(K+)=c(
);当V=bmL时,溶液中离子浓度有如下关系:c(K+)=c(![]() )+c(
)+c(![]() )+c(H2C2O4);则a__b(填“<”“=”或“>”).
)+c(H2C2O4);则a__b(填“<”“=”或“>”).