��Ŀ����
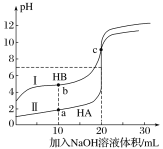
����Ŀ��ˮ�ĵ���ƽ��������ͼ��ʾ��

��1������A���ʾ25 ��ʱˮ�ڵ���ƽ��ʱ������Ũ�ȣ����¶�����100 ��ʱ��ˮ�ĵ���ƽ��״̬��B�㣬��100 ��ʱ��ˮ�����ӻ�Ϊ______________��
��2�������£���pH��10��Ba(OH)2��Һ��pH��5��ϡ�����ϣ�Ȼ��100 ��ĺ��£���ʹ�����ҺpH��7����Ba(OH)2������������Ϊ_______________________��
��3��25 ��ʱ����ˮ�м�������̼���ƹ��壬�õ�pHΪ11����Һ����ˮ������ӷ���ʽΪ_________________________����ˮ�������c(OH��)��_______________mol��L��1��
��4���������������Һ�У������ӵ������ʵ���������_____________(�����)��
��0.1 mol��L��1��CuSO4��Һ ��0.1 mol��L��1��Na2CO3
��0.1 mol��L��1��KCl ��0.1 mol��L��1��NaHCO3
��5��ij��Ԫ��(��ѧʽ��H2A��ʾ)��ˮ�еĵ��뷽��ʽ�ǣ�H2A===H����HA����HA��H����A2����
����Na2A��Һ��__________(����ԡ������ԡ����ԡ�)��NaHA��Һ��__________(����ԡ������ԡ����ԡ�)��
������0.1 mol��L��1 Na2A����Һ�����и�����Ũ�ȹ�ϵ��ȷ����__________(����ĸ)��
A��c(Na��)>c(A2��)>c(OH��)>c(HA��)
B��c(Na��)=2c(HA��)+2c((A2��)+2c(H2A)
C��c(Na��)+c(H��)=c(HA��)+c(A2��)+c(OH��)
D��c(OH��)=c(HA��)+c(H��)
���𰸡�10��12 2��9 CO32-��H2OHCO��OH����HCO��H2OH2CO3��OH�� 10��3 �� ���� ���� AD
��������
��1��KW=c��H+����c��OH-������2�������£���pH��10��Ba(OH)2��Һ��pH��5��ϡ�����ϣ�Ȼ��100 ��ĺ��£�ʹ�����ҺpH��7����ʱ��Һ�ʼ���������![]() ����Ba(OH)2����������������3��25 ��ʱ����ˮ�м�������̼���ƹ��壬̼������ӷֲ�ˮ�⣻ˮ��ٽ�ˮ���룬������ˮ�������c(OH��)������Һ�����������ӵ�Ũ�ȣ���4��Cl-��SO42-��ǿ�����������ˮ����CO32-��HCO3-
����Ba(OH)2����������������3��25 ��ʱ����ˮ�м�������̼���ƹ��壬̼������ӷֲ�ˮ�⣻ˮ��ٽ�ˮ���룬������ˮ�������c(OH��)������Һ�����������ӵ�Ũ�ȣ���4��Cl-��SO42-��ǿ�����������ˮ����CO32-��HCO3-
����ˮ�⣬��ˮ��̶�CO32->HCO3-����5����HA��H����A2�����棬����A2-ˮ�⣻H2A===H����HA�������棬HA��ֻ���벻ˮ�⣻��Na2A����Һ����A2��+H2OHA��+ OH-��H2OH++OH-����ƽ�⣻H2A��һ��������ȫ����Һ��û��H2A������c(Na��)+c(H��)=c(HA��)+c(A2��)+c(OH��)�����ϵ���غ��� c(OH��)=c(HA��)+c(H��)���������غ���
��1��KW=c��H+����c��OH-��������100 ��ʱ��ˮ�����ӻ�Ϊ=![]() ����2�������£���pH��10��Ba(OH)2��Һ��pH��5��ϡ�����ϣ�Ȼ��100 ��ĺ��£�ʹ�����ҺpH��7����ʱ��Һ�ʼ�����
����2�������£���pH��10��Ba(OH)2��Һ��pH��5��ϡ�����ϣ�Ȼ��100 ��ĺ��£�ʹ�����ҺpH��7����ʱ��Һ�ʼ�����![]() ��
��![]() �����
�����![]() 2��9�� ��3��25 ��ʱ����ˮ�м�������̼���ƹ��壬̼������ӷֲ�ˮ�⣬ˮ�����ӷ���ʽ��CO32-��H2OHCO��OH����HCO��H2OH2CO3��OH����ˮ��ٽ�ˮ���룬������ˮ�������c(OH��)������Һ�����������ӵ�Ũ�ȣ�����ˮ�������c(OH��)��10��3mol��L��1����4��Cl-��SO42-��ǿ�����������ˮ����CO32-��HCO3-����ˮ�⣬��ˮ��̶�CO32->HCO3-����������������������0.1 mol��L��1��Na2CO3��ѡ�ڣ���5����HA��H����A2�����棬����A2-ˮ�⣬Na2A��Һ�Լ�����H2A===H����HA�������棬HA��ֻ���벻ˮ�⣬����NaHA��Һ����������Na2A����Һ����A2��+H2OHA��+ OH-��H2OH++OH-����ƽ�⣬����c(Na��)>c(A2��)>c(OH��)>c(HA��)����A��ȷ��Na2A����ҺNa��Aԭ�Ӹ�������2:1��H2A��һ��������ȫ����Һ��û��H2A���ӣ����������غ㣬c(Na��)=2c(HA��)+2c((A2��)����B�����ݵ���غ㣬c(Na��)+c(H��)=c(HA��)+2c(A2��)+c(OH��)����C�����������غ㣬c(OH��)=c(HA��)+c(H��)����D��ȷ��
2��9�� ��3��25 ��ʱ����ˮ�м�������̼���ƹ��壬̼������ӷֲ�ˮ�⣬ˮ�����ӷ���ʽ��CO32-��H2OHCO��OH����HCO��H2OH2CO3��OH����ˮ��ٽ�ˮ���룬������ˮ�������c(OH��)������Һ�����������ӵ�Ũ�ȣ�����ˮ�������c(OH��)��10��3mol��L��1����4��Cl-��SO42-��ǿ�����������ˮ����CO32-��HCO3-����ˮ�⣬��ˮ��̶�CO32->HCO3-����������������������0.1 mol��L��1��Na2CO3��ѡ�ڣ���5����HA��H����A2�����棬����A2-ˮ�⣬Na2A��Һ�Լ�����H2A===H����HA�������棬HA��ֻ���벻ˮ�⣬����NaHA��Һ����������Na2A����Һ����A2��+H2OHA��+ OH-��H2OH++OH-����ƽ�⣬����c(Na��)>c(A2��)>c(OH��)>c(HA��)����A��ȷ��Na2A����ҺNa��Aԭ�Ӹ�������2:1��H2A��һ��������ȫ����Һ��û��H2A���ӣ����������غ㣬c(Na��)=2c(HA��)+2c((A2��)����B�����ݵ���غ㣬c(Na��)+c(H��)=c(HA��)+2c(A2��)+c(OH��)����C�����������غ㣬c(OH��)=c(HA��)+c(H��)����D��ȷ��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ����һ�������������̽����
��֪1 mol��ͬ�����ڲ�ͬ�����µ������
��ѧʽ | ���� | 1 mol�������/L |
H2 | 0 �棬101 kPa | 22.4 |
O2 | 0 �棬101 kPa | 22.4 |
CO | 0 �棬101 kPa | 22.4 |
H2 | 0 �棬202 kPa | 11.2 |
CO2 | 0 �棬202 kPa | 11.2 |
N2 | 273 �棬202 kPa | 22.4 |
NH3 | 273 �棬202 kPa | 22.4 |
��1�����ϱ������ó��Ľ��ۣ�
��1 mol�κ����壬�ڱ�״���µ������ԼΪ________��
��1 mol��ͬ�����壬�ڲ�ͬ�������£����________(�һ������һ��������һ����)��ȡ�
��2���������ݣ���ͬ�����£�1 mol�κ���������������ȣ�ԭ���ǣ�
��________________________________________________________________________��
��________________________________________________________________________��
��3��Ӧ�ã��ڱ�״���£�4 g O2�����Ϊ��������(д���������)___________________________________________________________________________
����Ŀ����һ�������������̽����
��֪1 mol��ͬ�����ڲ�ͬ�����µ������
��ѧʽ | ���� | 1 mol�������/L |
H2 | 0 �棬101 kPa | 22.4 |
O2 | 0 �棬101 kPa | 22.4 |
CO | 0 �棬101 kPa | 22.4 |
H2 | 0 �棬202 kPa | 11.2 |
CO2 | 0 �棬202 kPa | 11.2 |
N2 | 273 �棬202 kPa | 22.4 |
NH3 | 273 �棬202 kPa | 22.4 |
��1�����ϱ������ó��Ľ��ۣ�
��1 mol�κ����壬�ڱ�״���µ������ԼΪ________��
��1 mol��ͬ�����壬�ڲ�ͬ�������£����________(�һ������һ��������һ����)��ȡ�
��2���������ݣ���ͬ�����£�1 mol�κ���������������ȣ�ԭ���ǣ�
��________________________________________________________________________��
��________________________________________________________________________��
��3��Ӧ�ã��ڱ�״���£�4 g O2�����Ϊ��������(д���������)___________________________________________________________________________