��Ŀ����
����Ŀ����ҵ�ϳ��÷�¯��(��Ҫ��FeO��V2O5����������SiO2��P2O5������)��ȡV2O5���������£�

��1�����յ�Ŀ���ǽ�FeO��V2O3ת��Ϊ������NaVO3���ù����б�������Ԫ����_______________������������Ҫ�ɷ�Ϊ____________________(�ѧʽ)��
��2����MgSO4��Һ���衢��ʱ����������Ҫ�ɷ�Ϊ__________��
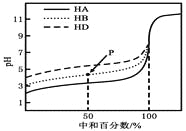
��3���ڱ���NH4VO3�Ĺ����У����������ļ���ֵ(������)���¶ȱ仯��������ͼ��ʾ��210��ʱ��ʣ��������ʵĻ�ѧʽΪ_____________________��

��4����V2O5ұ���������������ȷ����������ȷ�Ӧ��ʵ�������__________________.
��5����V2O5��������ϡ����õ�250mL(VO2)2SO4��Һ��ȡ25.00mL����Һ����ƿ�У���0.1000 mol��L-1H2C2O4����Һ���еζ����ﵽ�ζ��յ�ʱ���ı���Һ�����Ϊ20.00mL����֪�ζ�������H2C2O4������ΪCO2��VO2+(��ɫ)����ԭΪVO2+(��ɫ)��
�ٸõζ�ʵ�鲻��Ҫ�������ָʾ�����ﵽ�ζ��յ��������___________________��
��(VO2)2SO4��Һ�����ʵ����ʵ���Ũ��Ϊ___________________��
�۴ﵽ�ζ��յ�ʱ�����ӵζ��ܶ�����ʹ���_________(�ƫ�ߡ�����ƫ�͡�����Ӱ�족)��
���𰸡� Fe��V Fe2O3 MgSiO3��Mg3(PO4)2 HVO3 �����ȼ��Ϸ���һ��KClO3������þ������ȼ ��Һ�ɻ�ɫ��Ϊ��ɫ���Ұ�����ڲ��ָ� 0.080mol��L��1 ƫ��
����������¯������Ҫ��FeOV2O3����������SiO2��P2O5�����ʣ�������̼����ͨ��������գ�����ˮ�����˵õ�������Ҫ������������Һ�м�������þ��ȥ�����������ˣ���������Ҫ�ɷ�ΪMgSiO3��Mg3(PO4)2����Һ�м�������麟�������NH4VO3�����ȷֽ�����V2O5����
��1�����յ�Ŀ���ǽ�FeOV2O3ת��Ϊ������NaVO3���������Ͷ�����̼����Ӧ��Fe��VԪ�صĻ��ϼ����ߣ���˸ù����б�������Ԫ����Fe��V����ת��Ϊ�����������Խ���������Ҫ�ɷ�ΪFe2O3����2���������Ϸ�����֪��MgSO4��Һ���衢��ʱ��������Ҫ�ɷ�ΪMgSiO3��Mg3(PO4)2����3��NH4VO3�ֽ�Ĺ��������ɰ�����HVO3��HVO3��һ���ֽ�����V2O5��210��ʱ���ֽ�������Ͱ�������ʣ�����ռ��ʼ����ٷֺ���Ϊ100/117��100%=85.47%������210��ʱ��ʣ��������ʵĻ�ѧʽΪ��HVO3����4���������ȷ�Ӧ��ʵ������������ȼ��Ϸ���һ��KClO3������þ������ȼ����5������֪�ζ�������H2C2O4������ΪCO2��VO2+(��ɫ)����ԭΪVO2+(��ɫ)�����Ըõζ�ʵ�鲻��Ҫ�������ָʾ�����ﵽ�ζ��յ����������Һ�ɻ�ɫ��Ϊ��ɫ���Ұ�����ڲ��ָ����ڷ�Ӧ��VԪ�ػ��ϼ۴�+5�۽��͵�+4�ۣ��õ�1�����ӣ�̼Ԫ�ػ��ϼ۴�+3�����ߵ�+4�ۣ�ʧȥ1�����ӣ�����ݵ��ӵ�ʧ�غ��֪�μӷ�Ӧ��(VO2)2SO4�����ʵ������ڲ�������ʵ�������Ϊ0.1mol/L��0.02L����(VO2)2SO4��Һ�����ʵ����ʵ���Ũ��Ϊ![]() ���۴ﵽ�ζ��յ�ʱ�����ӵζ��ܶ����������ƫС�����ı�Һ������٣���˽�ʹ���ƫ�͡�
���۴ﵽ�ζ��յ�ʱ�����ӵζ��ܶ����������ƫС�����ı�Һ������٣���˽�ʹ���ƫ�͡�

 Сѧѧϰ�ð���ϵ�д�
Сѧѧϰ�ð���ϵ�д� Сѧͬ�����������ܾ�ϵ�д�
Сѧͬ�����������ܾ�ϵ�д�