题目内容
【题目】(选做题)本题包括A、B两小题。请选定其中一个小题,并在相应的答题区域内作答。若多做,则按A小题评分。
A.[物质结构与性质]
钴的合金及其配合物用途非常广泛。
(1)Co3+基态核外电子排布式为_____。
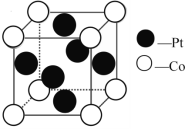
(2)一种Pt、Co金属间化合物可作为质子交换膜燃料电池的催化剂,其晶胞结构如图所示,该金属间化合物的化学式为_____。
(3)BNCP可用于激光起爆器等,BNCP可由HClO4、CTCN、NaNT共反应制备。
①ClO4-的空间构型为_____(用文字描述)。
②CTCN的化学式为[Co(NH3)4CO3]NO3,与Co(Ⅲ)形成配位键的原子是_____(已知CO32—的结构式为:![]() )。
)。
③NaNT可由![]() (双聚氰胺)为原料制备。双聚氰胺中碳原子杂化轨道类型为_____,1mol该分子中含
(双聚氰胺)为原料制备。双聚氰胺中碳原子杂化轨道类型为_____,1mol该分子中含![]() 键的数目为_____。
键的数目为_____。
B.[实验化学]
EDTA(乙二胺四乙酸)是螯合剂的代表物(沸点为116~117.2℃),可用于制备EDTAFeNa·3H2O等。实验室制备EDTA的实验步骤如下:
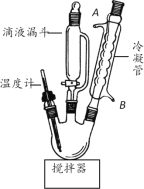
步骤1:在三口烧瓶中加入22.5gClCH2COOH、45mLH2O搅拌至溶解;在不断搅拌下,将含22gNaOH、60mLH2O、6.6g H2NCH2CH2NH2的盐酸盐所配成的溶液,从滴液漏斗中不断滴加到三口烧瓶中。
步骤2:加料完毕后,升温到102~106℃并保温,调节并保持 pH约为9,搅拌2h。
步骤3:加入活性炭,搅拌、静置、过滤。
步骤4:滤液用盐酸酸化至pH=1,放置、结晶、过滤、洗涤、干燥,制得EDTA。
(1)图中冷凝管装置的作用是_____,水从接口_____(填标号)通入。
(2)步骤3中加入活性炭的目的是_____;测定溶液pH的方法是_____。
(3)步骤4中“洗涤”时,能说明已洗涤完全的方法是_____。
(4)请补充完整由EDTA、NaHCO3、FeCl3·6H2O为原料制备EDTAFeNa·3H2O的实验方案(已知EDTANa4+FeCl3![]() EDTAFeNa + 3NaCl):向250mL烧杯中依次加入160mL蒸馏水、23gEDTA,搅拌至完全溶解,_____,再分次加入21.6g FeCl3·6H2O,保温20min,调pH小于5,冷却、抽滤、洗涤、干燥得EDTAFeNa·3H2O(实验中须使用的试剂为:NaHCO3,用量为26.8g)。
EDTAFeNa + 3NaCl):向250mL烧杯中依次加入160mL蒸馏水、23gEDTA,搅拌至完全溶解,_____,再分次加入21.6g FeCl3·6H2O,保温20min,调pH小于5,冷却、抽滤、洗涤、干燥得EDTAFeNa·3H2O(实验中须使用的试剂为:NaHCO3,用量为26.8g)。
【答案】[Ar]3d6或1s22s22p63s23p63d6 Pt3Co 正四面体 N和O sp和sp2 9NA 冷凝回流水和EDTA B 脱色 用玻璃棒蘸取溶液滴在pH试纸上,半分钟内与标准比色卡比较 取少量最后一次的洗涤过滤液于试管中,向其中滴加硝酸酸化的AgNO3溶液,若不产生白色沉淀,则表明已洗涤完全 将溶液加热到80℃并保温,分次加入26.8gNaHCO3,搅拌至溶液中无气泡
【解析】
A.(1)Co位于第四周期第VIII族,Co3+核外电子排布式为 [Ar]3d6或1s22s22p63s23p63d6 ;
(2)Co位于晶胞的顶点,个数为8×1/8=1,Pt位于晶胞的面心,个数为6×1/2=3,因此化学式为Pt3Co;
(3)①ClO4-中心原子Cl有4个σ键,孤电子对数为(7+1-4×2)/2=0,价层电子对数为4,ClO4-的空间构型为正四面体形;
②构成配位键,和中心原子提供空轨道,配原子提供孤电子对,根据CTCN的化学式,以及CO32-的结构式,与Co(III)形成配位键的原子是N和O;
③前一个C原子,有3个σ键,无孤电子对,杂化类型为sp2,后一个碳原子有2个σ键,无孤电子对,杂化类型为sp;成键原子之间只能形成一个σ键,即1mol该分子中含有σ键物质的量为9mol,个数为9NA。
B.(1)冷凝管的作用是冷凝回流水和EDTA;冷凝水进水方向一般是下进上出,即从接口B处通入;
(2)活性炭具有吸附性,能吸附有色物质,即加入活性炭的目的是脱色;测定溶液pH的方法是用玻璃棒蘸取溶液滴在pH试纸上,半分钟内与标准比色卡比较;
(3)EDTA表面含有Cl-,因此检验已洗涤完全的方法是检验Cl-是否存在,具体操作是取少量最后一次的洗涤过滤液于试管中,向其中滴加硝酸酸化的AgNO3溶液,若不产生白色沉淀,则表明已洗涤完全;
(4)根据反应方程式,温度在80℃时发生反应,根据所给原料以及后续实验,操作是将溶液加热到80℃并保温,分次加入26.8gNaHCO3,搅拌至溶液中无气泡;







