��Ŀ����
����Ŀ���弰�仯����㷺����ҽҩ��������ȼ���ȣ���±����Ĺ�ҵ�������£�
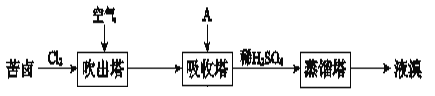
(1)Cl2�Ϳ�±�е�Br����Ӧ����Br2�����ӷ���ʽ��_____��
(2)���Ԫ�������ɽ���Cl�ķǽ�����ǿ��Br��ԭ��_____��
(3)�������У�A������Br2�����Һ�к���Br����BrO3������A��_____������ţ���
a��NaCl��Һ b��Na2CO3��Һ c��SO2����
(4)����������������Һ�м���ϡH2SO4�õ�Br2�����ӷ���ʽ��_____��
���𰸡�Cl2+2Br���TBr2+2Cl�� Cl��Br��Ϊ�ڢ�A��Ԫ�أ�ԭ��������������Ϊ7�����Ӳ���Cl��Br��ԭ�Ӱ뾶Cl��Br���õ�������Cl��Br���ǽ�����Cl��Br b 5Br��+BrO3��+6H+�T3Br2+3H2O
��������
(1)Cl2�Ϳ�±�е�Br-��Ӧ����Br2����Ӧ�����ӷ���ʽ��Cl2+2Br-=Br2+2Cl-��
(2)Cl��Br��Ϊ�ڢ�A��Ԫ�أ�ԭ��������������Ϊ7�����ڵ��Ӳ���Cl��Br��ԭ�Ӱ뾶Cl��Br�����Եõ�������Cl��Br��Ԫ�طǽ����ԣ�Cl��Br��
(3)�������У�A������Br2�����Һ�к���Br-��BrO3-��˵���嵥���ڼ���Һ�з�Ӧ������Br-��BrO3-��ѡb��
(4)����������������Һ�м���ϡH2SO4�õ�Br2�����ӷ���ʽ�ǣ�5Br-+BrO3-+6H+=3Br2+3H2O��