��Ŀ����
����Ŀ��������һ����Ҫ�Ļ���ԭ�ϣ��������������е�Ӧ��ʮ�ֹ㷺��ij��ѧ��ȤС����ʵ�����ж�Cl2��FeCl2��KSCN�����Һ�ķ�Ӧ������̽�����ش���������:
(1)Cl2Ϊ�Ʊ�
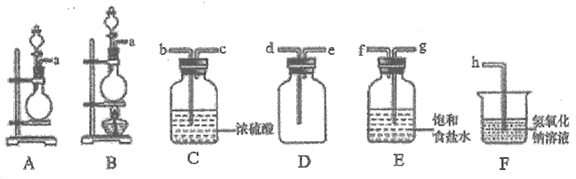
�ٸ�С��ͬѧѡ��KMnO4�����Ũ�����Ͽ����Ʊ�Cl2,���巢��װ��Ӧѡ��__(���д��ĸ)���÷�Ӧ�����ӷ���ʽΪ___________��
�����ռ�һƿ���﴿����������ѡ����ͼ�е�װ�ã�������˳��Ϊa��________(������������Сд��ĸ��ʾ)��
(2)Cl2������ʵ��
Cl2��FeCl2��KSCN�����Һ�ķ�Ӧ������Cl2����ͨ�룬Aװ������Һ�ȱ�죬������ɫ��
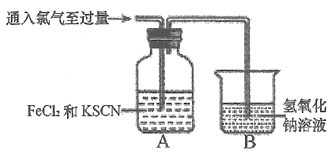
��װ��B�з�����Ӧ�����ӷ���ʽΪ___________��
��װ��A����Һ����ԭ����_________(�����ӷ���ʽ��ʾ)��
(3)����ʵ��̽��
Ϊ��̽����ͼAװ������Һ��ɫ��ȥ��ԭ��С��ȡ����A����ɫ�����Һ,�����м���_____(�ѧʽ)����Һ�ָ�Ϊ��ɫ���ɴ˵ó�����:SCN-��Cl2������
Ϊ��̽��SCN-��Cl2����������IJ�,��С������������̽��:
�ٲ������ϣ�����SCN-�е�Ԫ��Ϊ-3�ۡ�̼Ԫ��Ϊ+4�ۡ�
��ȡA����ɫ�����Һ���Թ��У������������ữ��BaCl2��Һ��������ɫ������
��ͨ��ʵ��֤����SCN-�е�Ԫ��ת��ΪNO3-��
��������ʵ��̽�����д��SCN-��Cl2��Ӧ�����ӷ���ʽΪ_____________��
���𰸡� A 2MnO4-+16H++10Cl-=2Mn2++5Cl2��+8H2O gfbcdeh Cl2+2OH-=Cl-+ClO-+H2O 2Fe2++Cl2=2Fe3++2C1-��Fe3++3SCN-=Fe(SCN)3 KSCN SCN-+8Cl2+9H2O=NO3-+SO42-+CO2+Cl-+18H+
����������1���ٸ�С��ͬѧѡ��KMnO4�����Ũ�����Ͽ����Ʊ�Cl2�������Һ�岻�����Ʊ�����ѡ��װ��A����Ӧ�����ӷ���ʽΪ2MnO4-+16H++10Cl-��2Mn2++5Cl2��+8H2O��������Ũ�����������Ʊ����������ռ�һƿ���﴿�����������Ʊ������������Ȼ����ˮ������ͨ������ʳ��ˮ��ȥ�Ȼ��⣬ͨ��Ũ�����ȥˮ�����������ܶȴ��ڿ��������������ſ������ռ��������Ҫβ��������������˳��Ϊ��agfbcdeh����2��������ͨ������������Һ������Ӧ�����Ȼ��ơ��������ƺ�ˮ����Ӧ�����ӷ���ʽΪCl2+2OH-��Cl-+ClO-+H2O����װ��A����Һ����ԭ�����������Ȼ���������Ϊ�Ȼ������Ȼ�����KSCN��Һ��Ӧʹ��Һ�Ժ�ɫ�����ӷ���ʽ�ֱ���2Fe2++Cl2��2Fe3++2C1-��Fe3++3SCN-��Fe(SCN)3����3�����ݽ��ۣ�SCN-��Cl2����˵�������м����������KSCN��SCN-��̼��+4�ۣ�����-3�ۣ��������-2�ۣ�̼�Ѿ�����������ˣ������ٱ������ˣ�ֻ��ת��Ϊ������̼�������������ữ��BaCl2��Һ��������ɫ������˵����ɫ����Ϊ���ᱵ������Һ������������ӣ�ͨ��ʵ��֤����SCN-�е�Ԫ��ת��ΪNO3-�����SCN-��Cl2��Ӧ�����ӷ���ʽΪSCN-+8Cl2+9H2O��NO3-+SO42-+CO2+Cl-+18H+��