题目内容
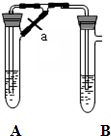 甲、乙两同学欲制取纯净的Fe(OH)2,根据如图所示的装置进行试验.A管中是Fe和稀硫酸,B管中是NaOH溶液,回答下列问题.
甲、乙两同学欲制取纯净的Fe(OH)2,根据如图所示的装置进行试验.A管中是Fe和稀硫酸,B管中是NaOH溶液,回答下列问题.(1)同学甲:先夹紧止水夹a,使A管开始反应,一段时间后在B管中观察到的现象是:①液面上升,②
(2)同学乙:先打开止水夹a,使A管中物质反应一段时间后,再夹紧止水夹a.实验中在B管中观察到的现象主要是
(3)你认为
分析:(1)Fe和稀硫酸反应生成氢气和硫酸亚铁,生成的氢气导致溶液通过导管进入B装置,氢氧化钠和硫酸亚铁反应生成氢氧化亚铁,Fe(OH)2不稳定易被空气氧化生成 Fe(OH)3;
(2)生成的氢气将空气排出,防止氢氧化亚铁被氧化;
(3)只要没有空气就能防止氢氧化亚铁被氧化.
(2)生成的氢气将空气排出,防止氢氧化亚铁被氧化;
(3)只要没有空气就能防止氢氧化亚铁被氧化.
解答:解:(1)A中反应为Fe+H2SO4=FeSO4+H2↑,氢气的生成导致A中压强增大,溶液从导管进入B试管,B中反应为FeSO4+2NaOH=Fe(OH)2↓+Na2SO4,Fe(OH)2不稳定易被空气氧化生成 Fe(OH)3,所以看到的现象是有白色沉淀生成,迅速变成灰绿色,最终变成红褐色,反应方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:有白色沉淀生成,迅速变成灰绿色,最终变成红褐色;4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(2)先打开止水夹a,使A管中物质反应一段时间后,再夹紧止水夹,A中生成的氢气将空气排出,生成的硫酸亚铁和氢氧化钠混合时氢氧化亚铁不被氧化,所以看到的现象是有白色沉淀生成(且不变色),
故答案为:有白色沉淀生成(且不变色);排尽试管中的空气,防止Fe(OH)2被氧化;
(3)通过以上分析知,乙同学的实验可制取纯净的Fe(OH)2,故答案为:乙.
故答案为:有白色沉淀生成,迅速变成灰绿色,最终变成红褐色;4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(2)先打开止水夹a,使A管中物质反应一段时间后,再夹紧止水夹,A中生成的氢气将空气排出,生成的硫酸亚铁和氢氧化钠混合时氢氧化亚铁不被氧化,所以看到的现象是有白色沉淀生成(且不变色),
故答案为:有白色沉淀生成(且不变色);排尽试管中的空气,防止Fe(OH)2被氧化;
(3)通过以上分析知,乙同学的实验可制取纯净的Fe(OH)2,故答案为:乙.
点评:本题考查了氢氧化亚铁的制备,氢氧化亚铁不稳定,易被空气氧化生成氢氧化铁而变质,为制取氢氧化亚铁,需要将空气隔绝,只要不存在氧气就能制得较纯净的氢氧化亚铁,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目


 Na2CO3溶液
Na2CO3溶液 NaHCO3溶液
NaHCO3溶液 Na2CO3固体
Na2CO3固体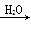 Na2CO3溶液
Na2CO3溶液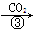 NaHCO3溶液
NaHCO3溶液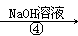 Na2CO3溶液
Na2CO3溶液