题目内容
某化学课外小组欲制取纯Na2CO3溶液并讨论实验过程中的相关问题。可供选择的试剂有:A.大理石 B.盐酸 C.氢氧化钠溶液 D.澄清石灰水。三名同学设计的制备实验方案的反应流程分别如下: 甲:NaOH溶液![]() Na2CO3溶液
Na2CO3溶液

请完成下列问题:
(1)请指出甲、乙两方案的主要缺点:
甲方案_______________________________________。
乙方案_______________________________________。
(2)若采用丙方案制取纯Na2CO3溶液,其实验的关键有________________。
(3)假设反应③所得的NaHCO3溶液中含有Na2CO3。现要利用A~D四种试剂证明Na2CO3的存在,你所选择的试剂有_________________(填试剂代号在题干中)。
(4)假设反应②所得的Na2CO3固体中混有未分解的NaHCO3。乙同学选择澄清石灰水测定其中NaHCO3的质量分数,乙同学能否达到实验目的?(填“能”或“不能”)。若能,请说明其计算需要的数据;若不能,请简要说明理由。
_____________________________________。
(1)甲方案:CO2的通入量不易控制乙方案:过程繁琐,操作复杂
(2)a反应③应充分进行,b反应③与④所用NaOH溶液的体积应相等
(3)A和B
(4)能固体样品的质量和沉淀总质量
解析:(1)因为2NaOH+CO2![]() 2Na2CO3+H2O,Na2CO3+H2O+CO2
2Na2CO3+H2O,Na2CO3+H2O+CO2![]() 2NaHCO3,两反应均无明显现象,不能控制反应。
2NaHCO3,两反应均无明显现象,不能控制反应。
(2)反应原理为:NaOH+CO2![]() NaHCO3 NaHCO3+NaOH
NaHCO3 NaHCO3+NaOH![]() Na2CO3+H2O
Na2CO3+H2O
1 1 1 1 1
(3)在盐酸中加入足量CaCO3,充分反应后过滤得CaCl2溶液,CaCl2+Na2CO3![]() CaCO3↓+2NaCl,不能用澄清石灰水,因为2NaHCO3+Ca(OH)2
CaCO3↓+2NaCl,不能用澄清石灰水,因为2NaHCO3+Ca(OH)2![]() Na2CO3+CaCO3↓+2H2O,即NaHCO3与澄清石灰水作用也会产生沉淀。(4)如设Na2CO3的物质的量为x,NaHCO3的物质的量为y,则有:
Na2CO3+CaCO3↓+2H2O,即NaHCO3与澄清石灰水作用也会产生沉淀。(4)如设Na2CO3的物质的量为x,NaHCO3的物质的量为y,则有:
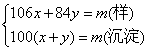
求出x、y即是。

 名校课堂系列答案
名校课堂系列答案
