题目内容
【题目】下列有关反应事实描述不正确的是
A.灼热的木炭与 CO2反应,反应物总能量低于生成物总能量
B.发生铝热反应时,铝粉与 Fe2O3需要在高温下反应,所以该反应是吸热反应
C.镁条和盐酸反应时,溶液的温度通常会上升
D.氢氧化钡晶体和氯化铵晶体的反应是吸热反应
【答案】B
【解析】
A. 灼热的木炭与 CO2反应,属于吸热反应,反应物总能量低于生成物总能量,故A正确;
B. 发生铝热反应时,铝粉与 Fe2O3需要在高温下反应,该反应是放热反应,吸热反应、放热反应与反应条件无关,故B错误;
C. 镁条和盐酸反应时放热,溶液的温度通常会上升,故C正确;
D. 氢氧化钡晶体和氯化铵晶体的反应是吸热反应,故D正确;
选B。

 ABC考王全优卷系列答案
ABC考王全优卷系列答案【题目】硝酸银是中学实验室常用试剂。硝酸银不稳定,易发生如下反应:
①2AgNO3(s)= 2Ag(s)+ 2N02(g)+O2(g) △H1
②2NO2(g)![]() N2O4(g) △H2
N2O4(g) △H2
(1)2AgNO3(s)= 2Ag(s)+N2O4(g)+O2(g) △H=___________(用含△H1、△H2的式子表示)。
(2)实验室配制硝酸银溶液的操作方法是:将一定量硝酸银固体溶于浓硝酸中,加水稀释至指定体积。“硝酸”的作用是____________________________________________。
(3)一定温度下,在5L的恒容密闭容器中投入34 g AgNO3(s)并完全分解测得混合气体的总物质的量(n)与时间(t)的关系如图所示。
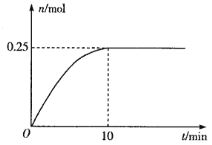
①下列情况能说明体系达到平衡状态的是___________(填字母)
a.Ag粉的质量不再改变 b.O2的浓度不再改变
c.NO2的体积分数不再改变 d.混合气体的密度不再改变
②反应开始到10min内N2O4的平均反应速率为___________mol·L-1·min-1。
③若达到平衡时,混合气体的总压强p=3.0MPa。在该温度下2NO2(g)![]() N2O4(g)的平衡常数Kp=___ (MPa)-1(结果保留2位小数)。[提示:用平衡时各组分分压替代浓度计算的平衡常数叫压强平衡常数(Kp),组分的分压(P1)=平衡时总压(P)×该组分的体积分数(
N2O4(g)的平衡常数Kp=___ (MPa)-1(结果保留2位小数)。[提示:用平衡时各组分分压替代浓度计算的平衡常数叫压强平衡常数(Kp),组分的分压(P1)=平衡时总压(P)×该组分的体积分数(![]() )]
)]
④达到平衡后,再向容器中充入少量的NO2,平衡2NO2(g)![]() N2O4(g)___________(填“向左”“向右”或“不”)移动,NO2的平衡转化率___________(填“增大”“减小”或“不变”)。
N2O4(g)___________(填“向左”“向右”或“不”)移动,NO2的平衡转化率___________(填“增大”“减小”或“不变”)。
(4)已知几种难溶物的溶度积如下表所示:
难溶物 | AgI | AgSCN | AgCl | Ag2CrO4 | Ag2S |
溶度积 | 8.5×10-17 | 1.2x10-12 | 1.8×10-10 | 1.1×10-11 | 6.7×10-50 |
颜色 | 黄色 | 白色 | 白色 | 红色 | 黑色 |
实验室常用AgNO3溶液滴定Cl-,宜选择___________作指示剂(填字母)
A.KI B. NH4SCN C. Na2CrO 4 D.K2S
(5)工业上,常用电解法精炼粗银。粗银中含有Cu、Au等杂质,用AgNO3溶液作电解质溶液。若以电流强度aA,通电bmin后,制得精银的质量为ckg,则该精炼装置的电流效率为___________(只要求列出计算式即可)。[已知:1mol电子带96500C(库仑)电量,电流效率等于阴极得电子数与通过电子总数之比]
【题目】联合国将2019年定为“国际化学元素周期表年”,2018年中国化学会制作了新版周期表,包含118种元素。回答下列问题:
J | B | ||||||||||||||||
M | x | ||||||||||||||||
A | |||||||||||||||||
(1)写出硅元素在周期表中的位置是______。
(2)化合物W是由AB两种元素构成的,用电子式表示其形成过程______________。
(3)用M单质作阳极,J单质作阴极,Ca(HCO3)2溶液作电解液,进行电解,阴极生成的气体和沉淀分别是______,阳极也生成气体和沉淀,写出阳极的电极反应式 ______ 。
(4)从原子结构角度解释碳化硅中碳元素显负价的原因______。
(5)第118号元素为Og(中文名“![]() ”,ào),下列说法正确的是______。
”,ào),下列说法正确的是______。
a.Og是第七周期0族元素 b.Og原子的核外有118个电子
c.Og在同周期元素中非金属性最强 d.中子数为179的Og核素符号是![]()
(6)已知X与Y是位于相邻周期的同主族元素。某温度下,X、Y的单质与H2化合生成气态氢化物的平衡常数分别为KX =9.7×1012、KY =5.6×107。Y是______(填元素符号),判断理由是______。