题目内容
【题目】如图所示:淀粉水解可产生某有机化合物A,A在不同的氧化剂作用下,可以生成B(C6H12O7)或C(C6H10O8),B和C都不能发生银镜反应。A.B.C都可以被强还原剂还原成为D(C6H14O6)。B脱水可得到五元环的酯类化合物E或六元环的酯类化合物F。

已知,相关物质被氧化的难易次序是:RCHO最易,R—CH2OH次之,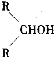 最难。请在下列空格中填写A.B.C.D.E、F的结构简式。
最难。请在下列空格中填写A.B.C.D.E、F的结构简式。
A: B: C:
D: E: F:
【答案】A.HOCH2(CHOH)4CHO B.HOCH2(CHOH)4COOH
C.HOOC(CHO)4COOH D.HOCH2(CHOH)4CH2OH
E  或
或 F
F  或
或
【解析】
试题分析:首先根据A是淀粉的水解产物及A的氧化产物B、C可确定A为葡萄糖。葡萄糖分子结构中有三种结构单元:一个—CHO、一个—CH2OH和四个![]() ,根据题给信息,—CHO最易被氧化,且B的分子组成(C6H12O7)只比CH2OH(CHOH)4CHO多一个O,所以B是CH2OH(CHOH)4CHO中—CHO被氧化为—COOH的产物,B的结构简式为:CH2OH(CHOH)4COOH。由C的分子组成比葡萄糖多两个O,少两个H可判断除醛基外还有一个醇羟基被氧化,根据题给信息,—CH2OH比
,根据题给信息,—CHO最易被氧化,且B的分子组成(C6H12O7)只比CH2OH(CHOH)4CHO多一个O,所以B是CH2OH(CHOH)4CHO中—CHO被氧化为—COOH的产物,B的结构简式为:CH2OH(CHOH)4COOH。由C的分子组成比葡萄糖多两个O,少两个H可判断除醛基外还有一个醇羟基被氧化,根据题给信息,—CH2OH比![]() 容易被氧化,所以是—CH2OH被氧化为—COOH,C的结构简式为:HOOC(CHOH)4COOH。由D的分子组成可判断,D是CH2OH(CHOH)4CHO中—CHO被还原为—CH2OH的产物,D的结构简式为:CH2OH(CHOH)4CH2OH。B中既有—COOH又有—OH,可以发生分子内酯化反应生成环状化合物,但—COOH与不同的C上的—OH反应形成的环的大小是不同的,根据E、F是五元环和六元环的酯,可确定E、F分别是—COOH与4、5位C上—OH酯化的产物(以—COOH上的C为1位C)。
容易被氧化,所以是—CH2OH被氧化为—COOH,C的结构简式为:HOOC(CHOH)4COOH。由D的分子组成可判断,D是CH2OH(CHOH)4CHO中—CHO被还原为—CH2OH的产物,D的结构简式为:CH2OH(CHOH)4CH2OH。B中既有—COOH又有—OH,可以发生分子内酯化反应生成环状化合物,但—COOH与不同的C上的—OH反应形成的环的大小是不同的,根据E、F是五元环和六元环的酯,可确定E、F分别是—COOH与4、5位C上—OH酯化的产物(以—COOH上的C为1位C)。

 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案【题目】钨主要用于制造硬质或耐高温的合金。自然界中黑钨矿的主要成分是铁和锰的钨酸盐(FeWO4、MnWO4),还含少量Si、P、As的化合物。黑钨矿冶炼钨的工艺流程如下:
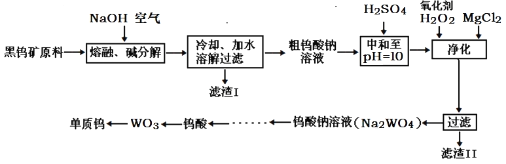
已知:①滤渣I的主要成份是Fe2O3、MnO2;
②上述流程中,除最后一步外,其余步骤中钨的化合价未变;
③常温下钨酸难溶于水。
回答下列问题:
(1)钨酸盐(FeWO4、MnWO4)中钨元素的化合价为__________,请写出MnWO4在熔融条件下发生碱分解反应生成MnO2的化学方程式____________。
(2)上述流程中向粗钨酸钠溶液中加硫酸调pH=10后,溶液中的杂质阴离子为SiO32-、HAsO32-、HAsO42-、HPO42-等,“净化”过程中,加入H2O2的目的是__________,滤渣Ⅱ的主要成分是__________。
(3)高温下密闭容器中用H2还原WO3可得到金属钨,其反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表。
温度 | 25℃ ~ 550℃ ~ 600℃ ~ 700℃ |
主要成分 | WO3 W2O5 WO2 W |
已知:温度过高时,WO2(s)可转变为WO2(g)。
WO2(s)+2H2(g) ![]() W(s)+2H2O(g) △H =+66.0 kJ·mol-1
W(s)+2H2O(g) △H =+66.0 kJ·mol-1
WO2(s) ![]() WO2(g) △H =+203.9 kJ·mol-1
WO2(g) △H =+203.9 kJ·mol-1
则在700℃时,WO2(g)与H2(g)反应生成固体W(s)的热化学方程式为_____________。
(4)已知氢氧化钙和钨酸钙(CaWO4)都是微溶性的电解质,两者的溶解度均随温度升高而减小。不同温度下两种物质的沉淀溶解平衡曲线如右图,则T1时Ksp(CaWO4) =________。
在钨酸钠溶液中加入石灰乳得到大量钨酸钙,则T2时该反应的平衡常数为________。
(5)利用电解法可以从碳化钨(WC)废料中回收钨。电解时,用碳化钨做阳极,不锈钢做阴极,盐酸为电解液,阳极析出钨酸并放出CO2,该阳极反应式为____________。



