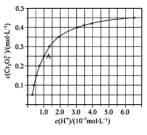
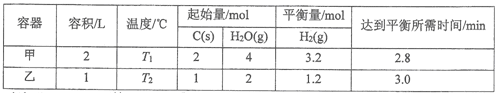
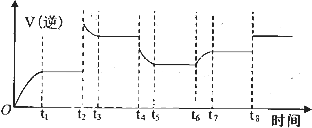
��Ŀ����
����Ŀ����ҵ���Ը�������Ҫ�ɷ�ΪFeO��Cr2O3����̼���ơ�����������Ϊԭ�������ظ�����(Na2Cr2O7��2H2O)������Ҫ��ӦΪ��
��4FeO��Cr2O3��8Na2CO3��7O2 ![]() 8Na2CrO4��2Fe2O3��8CO2
8Na2CrO4��2Fe2O3��8CO2
��2Na2CrO4��H2SO4![]() Na2SO4��Na2Cr2O7��H2O����˵������ȷ����( )
Na2SO4��Na2Cr2O7��H2O����˵������ȷ����( )
A. ��Ӧ��������Ϊ������ԭ��Ӧ
B. ��Ӧ������������O2����ԭ����FeO��Cr2O3
C. �����£�O2�������Դ���Fe2O3С��Na2CrO4
D. ����1mol��Na2Cr2O7ʱ��ת��5mol����
���𰸡�B
�����������������A����Ӧ��2���и�Ԫ�صĻ��ϼ��ڷ�Ӧǰ��δ�����仯�����Բ���������ԭ��Ӧ������B����Ӧ��1���У�������OԪ�صĻ��ϼ۽��͵�-2�ۣ�����������FeO��Cr2O3��Fe��Cr�Ļ��ϼ۾����ߣ�����ԭ������ȷ��C����Ϊ��������������Fe2O3��Na2CrO4������������������������Դ�����������������ԣ����������������Դ���Fe2O3��Na2CrO4������D������1mol��Na2Cr2O7ʱ������2molNa2CrO4������Ӧ��1���У����������������ʵ�����2��7/8mol=7/4mol��1mol�����μӷ�Ӧ����ת��4mol���ӣ���������1mol��Na2Cr2O7ʱ��ת��7mol���ӣ�����ѡB��

 ����ѧ�䵥Ԫ������ĩר����100��ϵ�д�
����ѧ�䵥Ԫ������ĩר����100��ϵ�д� �Ƹ�360�ȶ����ܾ�ϵ�д�
�Ƹ�360�ȶ����ܾ�ϵ�д� ���⿼����Ԫ���Ծ�ϵ�д�
���⿼����Ԫ���Ծ�ϵ�д� ��У���˳�̾�ϵ�д�
��У���˳�̾�ϵ�д�