题目内容
【题目】将N2和 H2按一定比例混合,在相同状况下其密度是H2的 3.6倍,取0.5mol该混合气体通入密闭容器内,使之发生反应并在一定条件下达到平衡。已知反应达到平衡后容器内压强是相同条件下反应前压强的0.76倍,试求:
(1)反应前混合气体中N2和 H2的体积比;
(2)达到平衡时混合气体中的氨的物质的量;
(3)平衡时N2的转化率。
【答案】
⑴1:4⑵0.12 mol⑶60%
【解析】
试题分析:⑴0.5mol混合气体中: 28g/mol ×n(N2)+2g/mol×n(H2)=0.5mol×3.6g/mol……①
n(N2)+ n(H2) =0.5mol……②
解得:n(N2)=0.1mol,n(H2)=0.4mol,
因此V(N2):V(H2)= n(N2): n(H2) =1:4,故答案为:1:4;
⑵平衡后容器内压强是相同条件下反应前压强的0.76倍, 即平衡后容器内气体的物质的量是相同条件下反应前气体的物质的量的0.76倍
N2 + 3H2![]() 2NH3
2NH3
起始/mol 0.1 0.4 0
变化/mol a 3a 2a
平衡/mol 0.1-a 0.4-3a 2a
(0.1-a)+(0.4-3a)+ 2a=0.76×0.5,解得:a=0.06,平衡时 n(NH3)=0.12 mol,故答案为:0.12;
⑶平衡时的N2转化率=amol/0.1mol=60%,故答案为:60%。

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案【题目】分人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注。
(1)工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如下:
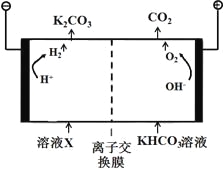
在阳极区发生的反应包括 和H ++ HCO3-= H2O + CO2↑。
简述CO32-在阴极区再生的原理 。
(2)再生装置中产生的CO2和H2在一定条件下反应生成甲醇等产物,工业上利用该反应合成甲醇。
已知:25 ℃,101 KPa下: H2(g) + 1/2 O2(g) ="==" H2O(g) ΔH1=" -242" kJ/mol
CH3OH(g) + 3/2 O2(g) ="==" CO2(g) + 2 H2O(g) ΔH2=" -676" kJ/mol
① 写出CO2和H2生成气态甲醇等产物的热化学方程式 。
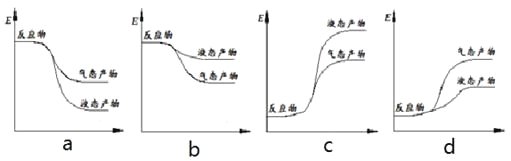
② 下面表示合成甲醇的反应的能量变化示意图,其中正确的是 (填字母序号)。
(3)在密闭的再生装置中,加入5 mol H2与2 mol CO2发生反应生成甲醇,反应达到平衡时,改变温度(T)和压强(P),反应混合物中甲醇(CH3OH)的物质的量分数变化情况如下图所示,下列说法正确的是
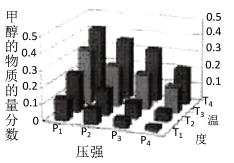
A.P1> P2> P3>P4 |
B.甲醇的物质的量分数越高,反应的平衡常数越大 |
C.图示中,该反应的温度变化为:T1> T2> T3>T4 |
D.T4、P4、时,H2的平衡转化率为60% |
(4)已知某种甲醇燃料电池中,电解质溶液为酸性,示意图如下:
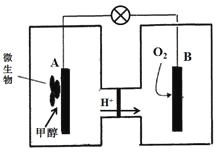
工作结束后,B电极室溶液的pH与工作前相比将 (填写“增大”、“减小”或“不变”,溶液体积变化忽略不计)。A电极附近甲醇发生的电极反应式为 。