题目内容
【题目】![]() 表示阿伏加德罗常数,下列说法正确的是
表示阿伏加德罗常数,下列说法正确的是
A.1mol硝基![]() 与46g二氧化氮
与46g二氧化氮![]() 所含的电子数均为
所含的电子数均为![]()
B.![]() 液与
液与![]() 溶液中的
溶液中的![]() 数目相同
数目相同
C.标准状况下,![]() 三氯甲烷中含碳氯共价键的数目为
三氯甲烷中含碳氯共价键的数目为![]()
D.向FeI2溶液中通入适量![]() ,当有
,当有![]() 被氧化时,转移的电子数为
被氧化时,转移的电子数为![]()
【答案】A
【解析】
A.46g二氧化氮![]() 的物质的量n=
的物质的量n=![]() =
=![]() =1mol,1个硝基和1个二氧化氮分子中都含有23个电子,1mol硝基与46g二氧化氮中都含有
=1mol,1个硝基和1个二氧化氮分子中都含有23个电子,1mol硝基与46g二氧化氮中都含有![]() 个电子,故A正确;
个电子,故A正确;
B.溶液体积未知,无法确定物质的量关系,故B错误;
C.标准状况下,三氯甲烷是液体,则![]() 三氯甲烷的物质的量不是
三氯甲烷的物质的量不是![]() ,故C错误;
,故C错误;
D.由于还原性:I->Fe2+,向FeI2溶液中通入![]() ,氯气先和
,氯气先和![]() 反应,待
反应,待![]() 反应完全后才和
反应完全后才和![]() 反应,但由于
反应,但由于![]() 的物质的量未知,故当有
的物质的量未知,故当有![]() 被氧化时,转移的电子数目一定大于
被氧化时,转移的电子数目一定大于![]() ,但具体是多少无法计算,故D错误;
,但具体是多少无法计算,故D错误;
答案选A。

 天天向上口算本系列答案
天天向上口算本系列答案【题目】从镍矿石尾矿中提取NiSO4是解决我国镍资源匮乏的一条重要途径,已知该过程如下:
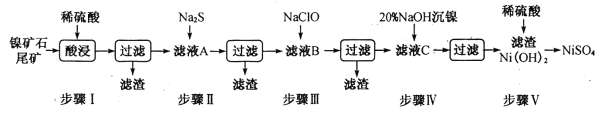
表1:各物质的Ksp数据如下表:
物质 | MnS | NiS | PbS | CuS | Ni(OH)2 |
Ksp | 2.5×10-13 | 1.1×10-21 | 8.0×10-28 | 6.3×10-36 | 2.0×10-15 |
表2:滤液A中各金属离子的含量如下表:
成分 | Ni2+ | Fe3+ | Fe2+ | Mn2+ | Cu2+ | Pb2+ | …… |
含量/g·L-1 | 3.80 | 4.80 | x | 0. 20 | 0.15 | <0.001 | …… |
根据以上信息,回答下列问题:
(1)步骤I酸浸之前需将矿石粉碎,目的是_______________。
(2)
(3)常温下进行步骤Ⅲ的目的是为了除去铁和锰元素,已知除铁元素的离子反应如下:2Fe2++ ClO - +5H2O=2Fe( OH)3↓+Cl- +4H+,此时Mn2+的氧化产物为MnO2,写出除锰元素的离子方程式_____________。
(4)所得Ni(OH)2是制造镍镉电池的重要原料,镍镉电池工作原理如下:Cd+2NiO(OH) +2H2O![]() Cd(OH)2+2Ni(OH)2,则随着放电的进行,正极区pH______(填“增大”、“减小”或“不变”);充电时阴极电极反应式为______________________。
Cd(OH)2+2Ni(OH)2,则随着放电的进行,正极区pH______(填“增大”、“减小”或“不变”);充电时阴极电极反应式为______________________。