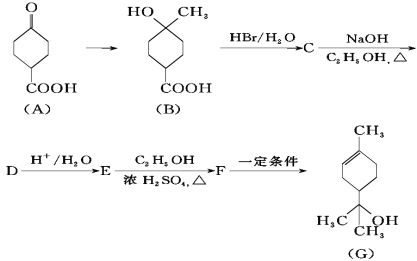
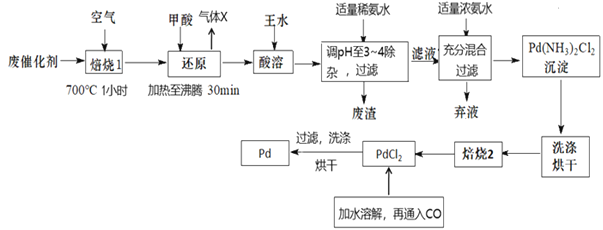
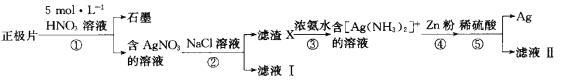
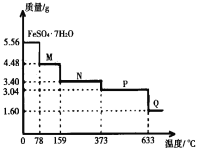
题目内容
【题目】室温下,用滴定管量取一定体积的浓氯水置于锥形瓶中,用NaOH溶液以恒定速度来滴定该浓氯水,根据测定结果绘制出ClO-、ClO3-等离子的物质的量浓度c与时间t的关系曲线如下。下列说法正确的是( )

A.NaOH溶液和浓氯水可以使用同种滴定管盛装
B.a点溶液中存在如下关系:c(Na+) + c(H+) = c(ClO-)+ c(OH-)+ c(ClO3-)
C.b点溶液中各离子浓度:c(Na+) > c(Cl-) > c(ClO-) = c(ClO3-)
D.t2~t4,ClO-的物质的量下降的原因可能是ClO-自身歧化:2ClO-= Cl-+ ClO3-
【答案】C
【解析】
A. NaOH能腐蚀活塞,所以不能盛放在酸式滴定管中;氯水溶液呈酸性且具有强氧化性,能腐蚀橡胶,所以不能盛放在碱式滴定管中,故A错误;
B. 该溶液中还含有Cl-,电解质溶液呈电中性,溶液中阴阳离子所带电荷相等,根据电荷守恒得c(Na+) + c(H+) = c(ClO-)+ c(OH-)+ c(Cl-)+ c(ClO3-),故B错误;
C. 根据图知,该溶液中c(ClO-) = c(ClO3-),氯气发生化学反应离子方程式为Cl2 + OH- = Cl-+ ClO- + H2O、3Cl2 + 6OH- = 5Cl-+ ClO- + 3H2O,根据方程式知c(Cl-) > c(ClO3-),根据电荷守恒知:c(Na+) + c(H+) = c(ClO-)+ c(OH-)+ c(Cl-)+ c(ClO3-),故c(Na+) > c(Cl-),所以存在c(Na+) > c(Cl-) > c(ClO-) = c(ClO3-),故C正确;
D. 该离子方程式转移电子不守恒,根据转移电子守恒得3ClO-= 2Cl-+ ClO3-,故D错误。
综上所述,答案为C。

 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案