题目内容
向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系如图所示。分析下列离子组在对应的溶液中一定能大量共存的是( )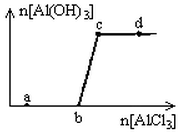
| A.a点对应的溶液中:Na+、Fe3+、SO42- 、NO3- |
| B.b点对应的溶液中:Na+、S2-、SO42- 、Cl- |
| C.c点对应的溶液中:Ag+、Ca2+、NO3-、Na+ |
| D.d点对应的溶液中:K+、NH4+、I-、HCO3- |
B
解析试题分析:向一定量的NaOH溶液中逐滴加入AlCl3溶液发生的化学反应为:4OH-+Al3+=AlO2-+2H2O .到B点是反应恰好完全。b—c段:3AlO2-+Al3++6H2O = 4Al(OH)3↓.当溶液中所有AlO2-完全转化后再加入AlCl3也不会产生沉淀了。A. a点对应的溶液中可能含有未反应的NaOH。在碱性溶液中Fe3+不能大量存在。错误。B. b点对应的溶液为NaAlO2和NaCl混合液。与Na+、S2-、SO42- 、Cl-不会发生任何反应。正确。C. c点对应的溶液中含有NaCl,Cl-与Ag+会发生离子反应而不能大量共存。错误。D. d点对应的溶液中含有大量的Al3+.Al3+和HCO3-发生双水解反应而不能大量共存。
考点:考查NaOH溶液和AlCl3溶液混合时溶液中的微粒与其它微粒共存问题的知识。

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
下列离子方程式书写正确的是( )
| A.向滴有酚酞的硅酸钠溶液中边加边振荡地滴加盐酸至红色变浅并接近消失 2H++SiO32—=H2SiO3(胶体) |
B.用惰性电极电解MgCl2溶液:2Cl—+2H2O Cl2↑+H2↑+2OH— Cl2↑+H2↑+2OH— |
C.碳酸氢铵溶液与足量的NaOH溶液混合后加热: NH4++OH- NH3↑+H2O NH3↑+H2O |
| D.5.6 g Fe与200 mL 2.0 mol/L HNO3溶液充分反应:3Fe + 2NO3—+ 8H+=3Fe2+ + 2NO↑ + 4H2O |
能正确表示下列反应的离子方程式为
| A.碳酸氢钠溶液中滴入氢氧化钙溶液:HCO3― + OH― = CO32―+ H2O |
| B.二氧化硫通入次氯酸钠溶液:SO2 + ClO― + 2OH―= SO42―+Cl―+H2O |
| C.硫化钡加入稀硫酸:BaS + 2H+= H2S↑+ Ba2+ |
| D.硅酸钠溶液与醋酸溶液混合:SiO32-+2H+=H2SiO3↓ |
在含有Fe2+、Fe3+、Al3+、NH4+的溶液中加入足量的Na2O2固体,再加入过量的稀HCl,完全反应后,离子数目几乎没有改变的是( )
| A.Fe2+ | B.Al3+ | C.Fe3+ | D.NH4+ |
下列各组离子在指定的溶液中不能大量共存的是
| A.滴入KSCN溶液显红色的溶液中:K+、Fe2+、SO42–、Cl– |
| B.1 mol·L–1的烧碱溶液中:S2–、SO32–、S2–、K+ |
| C.使淀粉碘化钾试纸变蓝的溶液中:Cs+、Ba2+、S2–、Cl– |
| D.含有大量HCO3–的澄清透明溶液中:K+、NH4+、Cl–、Na+ |
在酸性溶液中,一定能大量共存的离子组是
| A.Na+、NH4+、NO3— 、SO42— |
| B.Na+、Cu2+、Cl-、HCO3— |
| C.Fe2+、Ag+、 I-、NO3— |
| D.K+、Al3+ 、Ba2+、SO42— |
下列离子方程式正确的是
| A.氨水吸收足量的SO2气体:OH-+SO2=HSO3- |
| B.将铜丝投入稀硝酸中:Cu+4H++NO3-=Cu2++NO2↑+2H2O |
| C.将H2O2滴入酸性KMnO4溶液中:2MnO4-+10H++3H2O2=2Mn2++3O2↑+8H2O |
| D.NaHSO4溶液中加入过量Ba(OH)2溶液:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
下列表示对应化学反应的离子方程式正确的是
| A.用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O =3I 2+6OH- |
B.向NH4HCO3溶液中加过量NaOH溶液并加热:NH4++OH- NH3↑+H2O NH3↑+H2O |
| C.将过量二氧化硫气体通入冷氨水中:SO2+NH3·H2O=HSO3-+NH4+ |
| D.用稀硝酸洗涤试管内壁的银镜:Ag+2H++3NO3-=Ag++3NO↑+H2O |
下列离子方程式或化学方程式不正确的是
| A.向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色:2AgCl+S2—=Ag2S↓+2C1— |
| B.Na2O2在潮湿的空气中放置一段时间,变成白色粘稠物:2Na2O2 +2CO2=2Na2CO3+O2 |
| C.向酸性KMnO4溶液中加入H2O2:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O |
| D.在0.1mol/L CH3COONa溶液中:c(Na+)=c(CH3COOH)+c(CH3COO—) |