题目内容
(18分)常温下,在没有氧气存在时,铁与水几乎不反应,但高温下,铁能与水蒸气反应。请设计实验,证明还原铁粉与水蒸气能够发生反应。
(1) 铁粉与水蒸气反应的化学方程式是:
(2)证明还原铁粉与水蒸气发生了反应的方法是
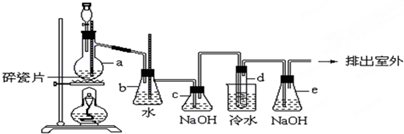
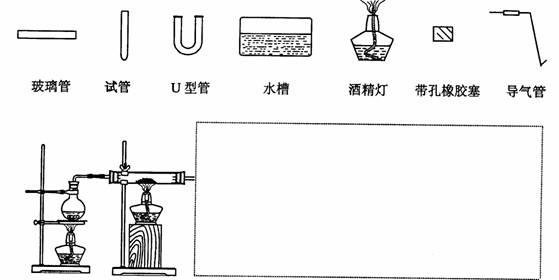
(3)某同学用如图所示装置进行实验,请帮助该同学完成设计,用下列简图画出未完成的实验装置示意图(铁架台可省略,导气管的形状可根据需要选择)
(4)停止反应,待装置冷却后,取出反应过的还原铁粉混合物,加入过量的稀硫酸充分反应,过滤。简述检验所得滤液中Fe3+的操作方法:
(5)经检验上述滤液中不含Fe3+,这不能说明还原铁粉与水蒸气反应所得产物中不含十3价的Fe元素。原因是(结合化学方程式说明)
(6)某同学利用上述滤液制取白色的Fe(OH)2、沉淀,向滤液中加入NaOH溶液后,观察至生成的白色的沉淀迅速变成灰绿色,最后变成红褐色。
①沉淀由白色→叶红褐色的化学方程式是:
②为了得到白色的Fe(OH)2沉淀,并尽可能长时间保持其白色,可采取的措施有多种,请写出其中的两种。
第一种:
第二种:
(l) 3Fe+4H2O(g) ![]() Fe3O4+4H2↑
Fe3O4+4H2↑
(2)检验足否有H2产生

(4)取少量溶液于试管中,滴入几滴KSCN溶液,"观察溶液颜色。如果颜色变红,说明溶液中含有Fe3+,否则不含Fe3+?
(5)如果反应过的还原铁粉混合物中的铁粉过量,铁粉将溶液中的Fe3+全部坯原为Fe2+,即便加KSCN溶液也不变红色。反应方程式为Fe+2FeCl3=3FeCl2,
(6)①4Fe(OH)2+O2+2H2O==4Fe(OH)3
②第一种: 用滴管加入水溶液中滴加氧氧化钠溶液
第二种: 向滤液中加入植物油,使滤液与空气隔绝,然后再用滴管伸入水溶液中滴加氢氧化钠溶液;
第三种:向热的硫酸亚铁溶液中滴加热的氢氧化钠溶液。减少溶液中氧气的含置。
(只要操作的目的是防止氧化,表述正确,即可得分)

 名校课堂系列答案
名校课堂系列答案| A、四种气态烃中至少有两种互为同分异构体 | B、可以用酸性高锰酸钾溶液鉴别乙和丙 | C、丙分子中所有原子均在同一平面上 | D、乙和丁属于同系物 |
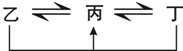 有A、B、C、D、E、F六种前四周期的元素,原子序数依次增大,A、B、C、D、E均为短周期元素,D和F元素对应的单质为日常生活中常见金属.A原子核内只有一个质子,元素A与B形成的气态化合物甲具有10e-、空间构型为三角锥形,C元素原子的最外层电子数是其电子层数的3倍,C与E同主族.图中均含D或F元素的物质均会有图示转化关系:
有A、B、C、D、E、F六种前四周期的元素,原子序数依次增大,A、B、C、D、E均为短周期元素,D和F元素对应的单质为日常生活中常见金属.A原子核内只有一个质子,元素A与B形成的气态化合物甲具有10e-、空间构型为三角锥形,C元素原子的最外层电子数是其电子层数的3倍,C与E同主族.图中均含D或F元素的物质均会有图示转化关系: