题目内容
1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度是2.18克/厘米3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂.在实验中可以用如图所示装置制备1,2-二溴乙烷.其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水).请填写下列空白: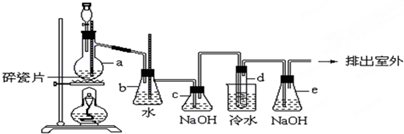
(1)写出制备1,2-二溴乙烷的化学方程式:
(2)请写出烧瓶a中发生反应的化学方程式:
(3)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞.请写出发生堵塞时瓶b中的现象:
(4)某学生做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超出许多,如果装置的气密性没有问题,试分析其可能的原因.
(5)c装置内NaOH溶液的作用是
分析:(1)乙烯与液溴发生加成反应生成1,2-二溴乙烷;
(2)乙醇在浓硫酸做催化剂、脱水剂条件下发生消去反应生成乙烯;
(3)依据当d堵塞时,气体不畅通,则在b中气体产生的压强将水压入直玻璃管中,甚至溢出玻璃管;
(4)根据乙烯与溴反应的利用率减少的可能原因进行解答;
(5)C中的氢氧化钠可以和制取乙烯中产生的杂质气体二氧化碳和二氧化硫发生反应;反应剩余的溴化氢、溴等有毒,能够污染大气,需要进行尾气吸收,用e吸收;
(2)乙醇在浓硫酸做催化剂、脱水剂条件下发生消去反应生成乙烯;
(3)依据当d堵塞时,气体不畅通,则在b中气体产生的压强将水压入直玻璃管中,甚至溢出玻璃管;
(4)根据乙烯与溴反应的利用率减少的可能原因进行解答;
(5)C中的氢氧化钠可以和制取乙烯中产生的杂质气体二氧化碳和二氧化硫发生反应;反应剩余的溴化氢、溴等有毒,能够污染大气,需要进行尾气吸收,用e吸收;
解答:解:(1)乙烯与液溴发生加成反应生成1,2-二溴乙烷化学方程式为:CH2=CH2+Br2→CH2BrCH2Br;
故答案为:CH2=CH2+Br2→CH2BrCH2Br;
(2)乙醇消去生成乙烯的反应方程式:CH3CH2OH
CH2=CH2↑+H2O,
故答案为:CH3CH2OH
CH2=CH2↑+H2O;
(3)试管d发生堵塞时,b中压强不断增大,会导致b中水面下降,玻璃管中的水柱上升,甚至溢出,
故答案为:b中水面会下降,玻璃管中的水柱会上升,甚至溢出;
(4)当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超过许多的原因可能是乙烯发生(或通过液溴)速度过快,导致大部分乙烯没有和溴发生反应;此外实验过程中,乙醇和浓硫酸的混合液没有迅速达到170℃会导致副反应的发生和副产物的生成,
故答案为:①乙烯流速过快,未完全发生加成反应、②发生副反应生成乙醚;
(5)装置C中盛有氢氧化钠可以和制取乙烯中产生的杂质气体二氧化碳和二氧化硫发生反应;
该反应中剩余的溴化氢及反应副产物溴单质等有毒,会污染大气,应该进行尾气吸收,所以装置e中氢氧化钠溶液的作用是吸收HBr等气体,防止大气污染,
故答案为:吸收乙烯气体中含有的CO2、SO2等酸性气体;吸收HBr等气体,防止大气污染.
故答案为:CH2=CH2+Br2→CH2BrCH2Br;
(2)乙醇消去生成乙烯的反应方程式:CH3CH2OH
| 浓硫酸 |
| 170℃ |
故答案为:CH3CH2OH
| 浓硫酸 |
| 170℃ |
(3)试管d发生堵塞时,b中压强不断增大,会导致b中水面下降,玻璃管中的水柱上升,甚至溢出,
故答案为:b中水面会下降,玻璃管中的水柱会上升,甚至溢出;
(4)当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超过许多的原因可能是乙烯发生(或通过液溴)速度过快,导致大部分乙烯没有和溴发生反应;此外实验过程中,乙醇和浓硫酸的混合液没有迅速达到170℃会导致副反应的发生和副产物的生成,
故答案为:①乙烯流速过快,未完全发生加成反应、②发生副反应生成乙醚;
(5)装置C中盛有氢氧化钠可以和制取乙烯中产生的杂质气体二氧化碳和二氧化硫发生反应;
该反应中剩余的溴化氢及反应副产物溴单质等有毒,会污染大气,应该进行尾气吸收,所以装置e中氢氧化钠溶液的作用是吸收HBr等气体,防止大气污染,
故答案为:吸收乙烯气体中含有的CO2、SO2等酸性气体;吸收HBr等气体,防止大气污染.
点评:本题考查了制备实验方案的设计、溴乙烷的制取方法,题目难度中等,注意掌握溴乙烷的制取原理、反应装置选择及除杂、提纯方法,培养学生分析问题、解决问题的能力.

练习册系列答案
相关题目

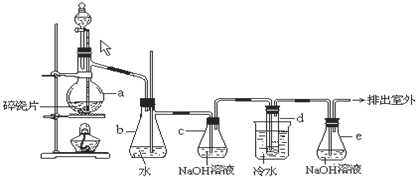 1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.18g?cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂.在实验室中可以用如图所示装置制备1,2-二溴乙烷,其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水).
1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.18g?cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂.在实验室中可以用如图所示装置制备1,2-二溴乙烷,其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水).