题目内容
【题目】叠氮化钠(NaN3)固体易溶于水,微溶于乙醇,不溶于乙醚,是汽车安全气囊中的主要成分,能在发生碰撞的瞬间分解产生大量气体将气囊鼓起。工业级NaN3 的制备分两步进行,反应方程式如下:
ⅰ.2Na+2NH3![]() 2NaNH2+H2
2NaNH2+H2
ⅱ.NaNH2+N2O![]() NaN3+H2O
NaN3+H2O
实验室利用如下装 置模拟工业级NaN3的制备。

回答下列问题:
实验Ⅰ:制备
(1)装置C中盛放的药品为____________________,装置D中进行油浴而不用水浴的主要原因是_______________________。
(2)N2O可由NH4NO3在240~245℃ 分解制得(硝酸铵的熔点为169.6℃),则可选择的气体发生装置是__________________(图中加热装置已略去),该反应的化学方程式为______________,在制备NaN3的实验过程中,当观察到_______________时开始通入N2O。

实验Ⅱ:分离提纯
反应完全结束后,取出装置D中的混合物进行以下操作,得到NaN3固体。

已知:NaNH2能与水反应生成NaOH 和氨气
(3)操作Ⅳ采用乙醚洗涤的原因是________________________。
实验Ⅲ:定量测定
实验室用滴定法测定叠氮化钠样品中NaN3的质量分数:①将2.500 g试样配成500.00 mL溶液。②取50.00 mL溶液置于锥形瓶中,加入50.00 mL 0.1010 mol·L-1(NH4)2Ce(NO3)6 溶液。③充分反应后,将溶液稍稀释,向溶液中加入8 mL浓硫酸,滴入3滴邻菲哕啉指示液,用0.0500 mol·L-1(NH4)2Fe(SO4)2标准溶液滴定过量的Ce4+,消耗溶液体积为29.00mL。测定过程的反应方程式为:2(NH4)2Ce(NO3)6+2NaN3=4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑
Ce4++Fe2+=Ce3++Fe3+。
(4)配制叠氮化钠溶液时,除需用到烧杯、玻璃棒、量筒外,还用到的玻璃仪器有_____________。
(5)试样中NaN3的质量分数为_______________。
【答案】 碱石灰 水的沸点为100℃,达不到210~220℃ ad NH4NO3![]() N2O↑+2H2O↑ 装置D中熔融钠单质的银白色光泽全部消失 NaN3不溶于乙醚,能减少其损失;可洗去NaN3固体表面的乙醇杂质;乙醚易挥发有利于产品快速干燥 500.00mL容量瓶、胶头滴管 0.9360(93.60%)
N2O↑+2H2O↑ 装置D中熔融钠单质的银白色光泽全部消失 NaN3不溶于乙醚,能减少其损失;可洗去NaN3固体表面的乙醇杂质;乙醚易挥发有利于产品快速干燥 500.00mL容量瓶、胶头滴管 0.9360(93.60%)
【解析】(1)A中产生的氨气混有水蒸气,干燥氨气选择碱石灰,则在C中盛放的药品是碱石灰;装置D中发生反应之一:NaNH2+N2O![]() NaN3+H2O,该反应需要温度较高,而水浴温度达不到反应所需的温度210℃-220℃,所以进行油浴而不用水浴;
NaN3+H2O,该反应需要温度较高,而水浴温度达不到反应所需的温度210℃-220℃,所以进行油浴而不用水浴;
(2)N2O可由NH4NO3在240~245℃分解制得(硝酸铵的熔点为169.6℃),在制得N2O之前,NH4NO3就已经熔化,故试管不能向下倾斜,以防熔化后的NH4NO3流下,故不用c,NH4NO3分解会得到水,若用b装置,水蒸气冷凝后会掉在试管底部,试管会炸裂,故不用b,故气体发生装置选ad;该反应的化学方程式为NH4NO3![]() N2O↑+2H2O↑;在制备NaN3的实验过程中,当Na和NH3完全反应时,开始通入N2O发生NaNH2+N2O
N2O↑+2H2O↑;在制备NaN3的实验过程中,当Na和NH3完全反应时,开始通入N2O发生NaNH2+N2O![]() NaN3+H2O,制得NaN3,所以当观察到装置D中熔融钠单质的银白色光泽全部消失时开始通入N2O;
NaN3+H2O,制得NaN3,所以当观察到装置D中熔融钠单质的银白色光泽全部消失时开始通入N2O;
(3)D中混合物加水后,根据叠氮化钠(NaN3)固体易溶于水,微溶于乙醇,不溶于乙醚,NaN3溶解在水中,NaNH2与水反应生成NaOH和氨气,可知操作Ⅱ加乙醇可降低NaN3的溶解度促使NaN3析出;乙醚洗涤叠氮化钠可减少叠氮化钠的损失;故操作Ⅳ采用乙醚洗涤的原因是NaN3不溶于乙醚,能减少其损失;可洗去NaN3固体表面的乙醇杂质;乙醚易挥发有利于产品快速干燥;
(4)配制500.00mL叠氮化钠溶液时,除需用到烧杯、玻璃棒、量筒外,还用到的玻璃仪器500.00mL容量瓶和胶头滴管;
(5)结合滴定过程,将2.500g试样配成500.00mL溶液,取50.00mL溶液置于锥形瓶中,叠氮化钠和六硝酸铈铵反应,剩余的六硝酸铈铵,加入浓硫酸,用0.0500molL-1(NH4)2Fe(SO4)2(硫酸亚铁铵)标准滴定溶液滴定过量的Ce4+,结合化学方程式定量关系计算:
2(NH4)2Ce(NO3)6+2NaN3=4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑
Ce4++Fe2+=Ce3++Fe3+。
n[(NH4)2Ce(NO3)6]=0.1010molL-1×50.00×10-3L=5.050×10-3mol,
n[(NH4)2Fe(SO4)2]=0.0500molL-1×29.00×10-3L=1.450×10-3mol,
与NaN3反应的n[(NH4)2Ce(NO3)6]=5.050×10-3mol-1.450×10-3mol=3.600×10-3mol,故500.00mL溶液中(2.500g试样中)n(NaN3)=0.036mol,ω=![]() ×100%=×100%= 93.60%。
×100%=×100%= 93.60%。

 阅读快车系列答案
阅读快车系列答案【题目】某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白:
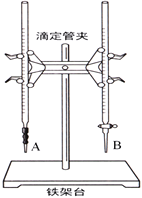
(1)下图中______(填“A”或“B”)是碱式滴定管,进行该实验的第一步操作是____________________。
(2)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色变化,直到因加入一滴盐酸后,出现_____________________________(填“现象”)说明达到滴定终点。
(3)下列操作中可能使所测NaOH溶液的浓度数值偏低的是(____)
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
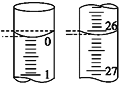
(4)若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用盐酸溶液的体积为________mL。
(5)某学生根据3次实验分别记录有关数据如下表:
滴定次数 待测NaOH溶液的体积/mL | 0.100 0 mol·L-1盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | ||
第一次 | 25.00 | 0.00 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 |
第三次 | 25.00 | 0.22 | 26.31 |
依据上表数据列式计算该NaOH溶液的物质的量浓度(写出简要过程)。______________





