题目内容
【题目】甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,可能发生的反应如下:
I.CO(g)+H2O(g)![]() CO2(g)+H2(g) △H1=-41.0kJ/mol
CO2(g)+H2(g) △H1=-41.0kJ/mol
II.CO(g)+2H2(g)![]() CH3OH(g) △H2=-90.0kJ/mol
CH3OH(g) △H2=-90.0kJ/mol
III.CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3
回答下列问题:
(1)则△H3=______,在以上制备甲醇的两个反应中,反应II优于反应III,其原因为______。
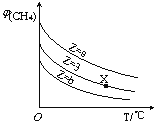
(2)一定化例的合成气在装有催化剂的反应器中反应12小时,体系中甲醇的产率和催化剂的催化活性与温度的关系如图1所示。

当温度为470K时,图中P点_____(填“是”或“不是”)处于平衡状态。490K之后,甲醇产率下降的原因是____________。
(3)图2为一定比例的CO2、H2,CO、H2,CO、CO2、.H2条件下甲醇生成速率与温度的关系。
①490K时,根据曲线a、c判断合成甲醇的反应机理是______(填“A"或“B").
A. ![]() B.
B. ![]()
②490K时,曲线a与曲线b相比,CO的存在使甲醇生成速率增大,结合反应I、III分析原因______________________。
(4)研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的电极反应式为_____。
【答案】 - 49.0 kJ·mol-1 反应Ⅱ符合“原子经济性”的原则即原子利用率为100%(绿色化学) 不是 反应Ⅱ、Ⅲ均为放热反应,升高温度,平衡逆向移动,且催化剂活性降低 B CO促进反应Ⅰ正向移动,二氧化碳和氢气的量增加,水蒸气的量减少,有利于反应III正向进行 CO2+6H++6e==CH3OH+H2O
【解析】(1)根据盖斯定律:反应Ⅱ-反应Ⅰ=反应Ⅲ,故△H3=△H2-△H1=-90.0kJ/mol-(-41.0kJ/mol
)= - 49.0 kJ·mol-1 ,由于反应Ⅱ生成物只有甲醇,原子利用率为100%,符合“原子经济性”的原则(绿色化学),故反应II优于反应III,因此,本题答案为:- 49.0 kJ·mol-1 ;反应Ⅱ符合“原子经济性”的原则即原子利用率为100%(绿色化学)。
温度为470K时,图中P点甲醇产率没有达到最大,不是处于平衡状态。反应Ⅱ、Ⅲ均为放热反应,490K之后,升高温度平衡逆向移动,且催化剂活性降低,使甲醇产率下降,故本题答案为:不是; 反应Ⅱ、Ⅲ均为放热反应,升高温度,平衡逆向移动,且催化剂活性降低。
(3))图2为一定比例的CO2、H2,CO、H2,CO、CO2、.H2条件下甲醇生成速率与温度的关系。①490K时,从甲醇的生成速率来看,a曲线大于c曲线,即甲醇来源于CO2和H2
故490K时,根据曲线a、c判断合成甲醇的反应机理是 B;②490K时,曲线a与曲线b相比,CO的存在使甲醇生成速率增大,从化学热力学,结合反应I、III分析,对I.CO(g)+H2O(g)![]() CO2(g)+H2(g),CO是反应物,CO促进反应I正向移动,CO2和H2
CO2(g)+H2(g),CO是反应物,CO促进反应I正向移动,CO2和H2
的量增加,水蒸气的量减少,反应III.CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) 正向进行,故
CH3OH(g)+H2O(g) 正向进行,故
CO的存在使甲醇生成速率增大。
(4)CO2在酸性水溶液中通过电解生成甲醇,CO2中碳元素化合价降低,被还原,发生还原反应,则生成甲醇的电极反应式为:CO2+6H++6e==CH3OH+H2O。