题目内容
20.下列物质中,在一定条件下,既能发生消去反应,又能发生水解反应的是( )| A. | 一氯甲烷 | B. | 乙醇 | C. | 溴乙烷 | D. |  |
分析 卤代烃发生消去反应的结构特点是:与-X相连碳的相邻碳原子上有氢原子的才能发生消去反应,形成不饱和键;
所有卤代烃均能发生水解反应,反应实质为-X被-OH取代,醇类不能发生水解反应.
解答 解:A.CH3Cl只含有1个碳原子,不能发生消去反应,故A错误;
B.乙醇不能发生水解反应,故B错误;
C.溴乙烷能发生消去反应生成乙烯,发生水解反应生成乙醇,故C正确;
D.与Cl原子相连的碳原子的相邻碳原子上没有氢原子,所以不能发生消去反应,故D错误,故选C.
点评 本题主要考查卤代烃的消去反应和水解反应,难度不大,注意卤代烃、醇发生消去反应的结构特点是:只有-X(-OH)相连碳原子的相邻碳上有氢原子的才能发生消去反应.

练习册系列答案
相关题目
11.下列关于有机物的叙述不正确的是( )
| A. | 油脂、乙酸乙酯都属于酯类,但不是同系物 | |
| B. | 在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH | |
| C. | 分子式为C3H7Cl的同分异构体共有2种 | |
| D. | 谷氨酸分子(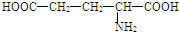 )间缩合可形成二肽 )间缩合可形成二肽 |
8. 现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
(1)A的基态原子最外层有4种不同运动状态的电子,F位于ds区.
(2)E2+的基态核外电子排布式为1s22s22p63s23p63d5,AD4为非极性(填极性或非极性)分子.
(3)A、B、C三种元素的电负性由小到大的顺序是C<N<O(用元素符号表示),B和C两元素中,B的第一电离能较大的原因是N元素的2p轨道上电子处于半满状态,是一种稳定结构,与AC2互为等电子体的分子的名称为一氧化二氮.(只写一种)
(4)BD3中心原子的杂化方式为sp3杂化,其分子空间构型为三角锥形.
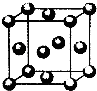
(5)用晶体的x射线衍射法对F的测定得到以下结果:F的晶胞为面心立方最密堆积(如右图),又知该晶体的密度为ρg/cm3,晶胞中该原子的配位数为12;F的原子半径是$\sqrt{2}×\root{3}{\frac{4}{{N}_{A}ρ}}$×1010pm;(阿伏加德罗常数为NA).
 现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.| A原子核外电子分占3个不同能级,且每个能级上排布的电子数相同 |
| B元素原子的核外p电子总数比s电子总数少1 |
| C原子p轨道上成对电子数等于未成对电子数,且与A同周期 |
| D元素的族序数与周期数的差为4,且不与A元素在同一周期 |
| E位于周期表中第七列 |
| F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子 |
(2)E2+的基态核外电子排布式为1s22s22p63s23p63d5,AD4为非极性(填极性或非极性)分子.
(3)A、B、C三种元素的电负性由小到大的顺序是C<N<O(用元素符号表示),B和C两元素中,B的第一电离能较大的原因是N元素的2p轨道上电子处于半满状态,是一种稳定结构,与AC2互为等电子体的分子的名称为一氧化二氮.(只写一种)
(4)BD3中心原子的杂化方式为sp3杂化,其分子空间构型为三角锥形.
(5)用晶体的x射线衍射法对F的测定得到以下结果:F的晶胞为面心立方最密堆积(如右图),又知该晶体的密度为ρg/cm3,晶胞中该原子的配位数为12;F的原子半径是$\sqrt{2}×\root{3}{\frac{4}{{N}_{A}ρ}}$×1010pm;(阿伏加德罗常数为NA).
9.下列结论均出自《实验化学》中的实验,其中错误的是( )
| A. | 往新配制的可溶性淀粉溶液中滴加碘水,溶液显蓝色,用CCl4不能从中萃取出碘 | |
| B. | 当锌完全溶解后,铁与酸反应产生氢气的速率会显著减慢,此现象可作为判断镀锌铁皮中锌镀层是否完全被反应掉的依据 | |
| C. | 制备硫酸亚铁铵晶体时,最后在蒸发皿中蒸发浓缩溶液时,只需小火加热至溶液表面出现晶膜为止,不能将溶液全部蒸干 | |
| D. | 提取海带中碘元素时,为保证I-完全氧化为I2,加入的氧化剂(H2O2或新制氯水)均应过量 |
6.下列说法不正确的是( )
| A. | 向新制氯水中加入少量CaCO3粉末后,溶液的pH减小 | |
| B. | SO2、CH2═CH2都能使溴水褪色,但原理不同 | |
| C. | NaHCO3、CH3COONH4都能分别和盐酸、烧碱溶液反应 | |
| D. | FeSO4溶液、Na2SO3溶液在空气中都易因氧化而变质 |
 J?mol—1
J?mol—1 的一个课题,污染分为空气污染,水污染,土壤污染等。
的一个课题,污染分为空气污染,水污染,土壤污染等。 ,反应为:(NH4)2CO3(aq)+H2O(l)+CO2(g)=2NH4HCO3 (aq) ΔH3 为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),在t时刻,测得容器中CO2气体的浓度。然后分别在温度为T2、T3、T4、T5下,保持其他初始实验条件不变,重复上述实验,经过相同时间测得CO2气体浓度,其关系如图
,反应为:(NH4)2CO3(aq)+H2O(l)+CO2(g)=2NH4HCO3 (aq) ΔH3 为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),在t时刻,测得容器中CO2气体的浓度。然后分别在温度为T2、T3、T4、T5下,保持其他初始实验条件不变,重复上述实验,经过相同时间测得CO2气体浓度,其关系如图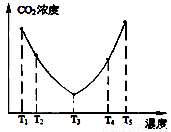
 .(其它无机物任选)
.(其它无机物任选)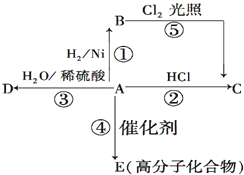 某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应.
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应. (反应类型加聚反应 ).
(反应类型加聚反应 ).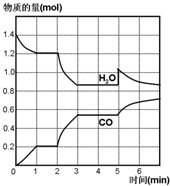 在一容积为2L的密闭容器中,高温下发生下列反应:C(s)+H2O(g)CO(g)+H2(g),其中H2O、CO的物质的量(mol)随时间(min)的变化曲线如图所示:
在一容积为2L的密闭容器中,高温下发生下列反应:C(s)+H2O(g)CO(g)+H2(g),其中H2O、CO的物质的量(mol)随时间(min)的变化曲线如图所示: