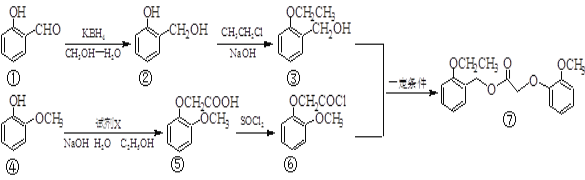
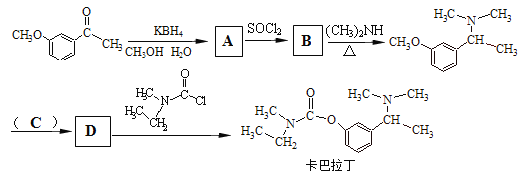
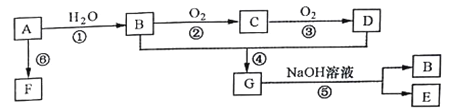
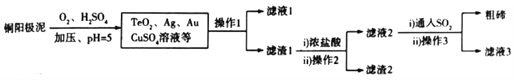
题目内容
【题目】常温下.Ksp(PbI2)=8.5×10-9。取适量黄色PbI2粉末溶于水中,充分揽拌后得到浊液,过滤。在滤液中加入少量KI,测得c(I-)=1.0×10-2mol·L-1。下列说法正确的是( )
A. Ksp(PbI2)减小 B. 溶液中c(I-)减小
C. 产生黄色沉淀 D. 溶液中c(Pb2+)=8.5×10-7mol·L-1
【答案】C
【解析】常温下.Ksp(PbI2)=8.5×10-9。取适量黄色PbI2粉末溶于水中,充分揽拌后得到浊液,过滤。Ksp(PbI2)= c(Pb2+)![]() c2(I-)=4 c3(Pb2+)=8.5×10-9,所以在滤液中,c(Pb2+)=1.3×10-3 mol·L-1,c(I-)=2.6×10-3mol·L-1。在滤液中加入少量KI,测得c(I-)=1.0×10-2mol·L-1,则c(Pb2+)=
c2(I-)=4 c3(Pb2+)=8.5×10-9,所以在滤液中,c(Pb2+)=1.3×10-3 mol·L-1,c(I-)=2.6×10-3mol·L-1。在滤液中加入少量KI,测得c(I-)=1.0×10-2mol·L-1,则c(Pb2+)=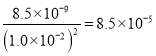 mol·L-1<1.3×10-3 mol·L-1,所以溶液中一定会产生PbI2黄色沉淀。A. Ksp(PbI2)只与温度有关,温度不变,其值不变,A不正确;B. 溶液中c(I-)明显增大了,B不正确;C. 产生黄色沉淀,C正确; D. 溶液中c(Pb2+)=8.5×10-5mol·L-1,D不正确。本题选C。
mol·L-1<1.3×10-3 mol·L-1,所以溶液中一定会产生PbI2黄色沉淀。A. Ksp(PbI2)只与温度有关,温度不变,其值不变,A不正确;B. 溶液中c(I-)明显增大了,B不正确;C. 产生黄色沉淀,C正确; D. 溶液中c(Pb2+)=8.5×10-5mol·L-1,D不正确。本题选C。

【题目】下表为元素周期表的一部分,请按要求回答问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | ④ | ⑤ | |||
3 | ⑥ | ⑦ | ⑧ | ⑨ |
(1)表中元素______的非金属性最强,元素_____的金属性最强(填元素符号)。
(2)表中元素③的原子结构示意图______;元素⑨形成的氢化物的电子式___________。
(3)表中元素④、⑨形成的氢化物的稳定性顺序为_____> (填化学式)。
(4)表中元素⑧和⑨的最高价氧化物对应水化物的酸性强弱为_____> (填化学式)。
(5)表中元素③、④、⑥、⑦的原子半径大小为____> > > (填元素符号)。
【题目】锌锰干电池是最早的实用电池。现用下列工艺回收正极材料中的金属(部分条件未给出)。
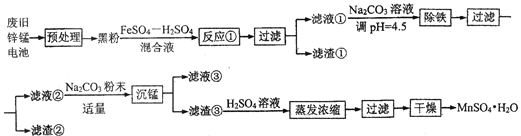
(1)碱性锌锰电池反应为:Zn+2MnO2+2H2O=Zn(OH)2+2MnO(OH),电解质是KOH,该电池的负极材料为__________(填化学式),MnO(OH)中Mn的化合价为:________,正极反应式为:__________。
(2)黑粉的主要成份为 MnO2和石墨,写出反应①的化学方程式:______。
(3)MnO2的转化率与温度的关系如下表:
温度/℃ | 20 | 40 | 60 | 80 | 100 |
转化率/℃ | 86.0 | 90.0 | 91.3 | 92.0 | 92.1 |
生产中常选反应温度为80℃,其理由是:_______。
(4)“沉锰”过程中生成碱式碳酸锰[MnCO36Mn(OH)25H2O],写出其离子反应方程式:_______,检验沉淀是否洗净的操作是:_______。滤液③中可回收的物质为:________(填化学式)。
(5)“预处理”时,废旧锌锰电池经过拆解、筛分得到炭包,其中含 MnO2为34.8%。称取5.000 g炭包,经处理得到3.211 g MnSO4H2O,计算锰的回收率为:_____。