题目内容
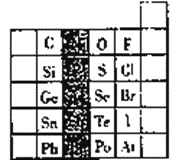
【题目】9.6g 元素A与4.2g元素B含有相同的原子数,A和B原子核中质子数与中子数相等,已知A元素在其最高价氧化物中的含量是40%,在其氢化物中含量为94.1%。试计算A、B两元素的相对原子质量,并推算出它们在周期表中的位置。______________
【答案】A、B两元素的相对原子质量分别为:32、14,他们在周期表中的位置分别为:第三周期ⅥA族;第二周期VA族
【解析】
令A元素最高正化合价为a,则最低负化合价为(a-8),A的相对分子质量为b,
A元素最高价氧化物中A原子与O原子数目之比为2:a,由A元素在其最高价氧化物中的含量是40%,则2b:16a=40%:(1-40%),元素A的氢化物化学式为H(8-a)A,结合A元素质量分数可得:![]() =94.1%,联立方程,解得b=32,A原子核中质子数与中子数相等,相对原子质量-质子数+中子数,所以质子数为16,在周期表中第三周期ⅥA族;
=94.1%,联立方程,解得b=32,A原子核中质子数与中子数相等,相对原子质量-质子数+中子数,所以质子数为16,在周期表中第三周期ⅥA族;
令B元素相对分子质量为n,9.6g元素A与4.2g元素B含有相同的原子数,则![]() 解得n=14,B原子核中质子数与中子数相等,则B的质子数为7,为N元素,处于周期表中第二周期VA族。
解得n=14,B原子核中质子数与中子数相等,则B的质子数为7,为N元素,处于周期表中第二周期VA族。
【点晴】
掌握化学式中元素质量分数计算是解题的关键;A元素最高正化合价为a,则最低负化合价为(a-8),A的相对分子质量为b,其最高价氧化物中A原子与O原子数目之比为2:a,由A元素在其最高价氧化物中的含量是40%,则2b:16a=40%:(1-40%),元素A的氢化物化学式为H(8-a)A,结合A元素质量分数列方程,联立方程可得A元素相对分子质量,进而计算B的相对分子质量,A和B原子核中质子数与中子数相等,相对原子质量-质子数+中子数,求出各自的质子数,确定元素的种类以及他们在周期表中的位置。

 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案【题目】某学生探究如下实验(A):
实验A | 条件 | 现象 |
| 加热 | i.加热后蓝色褪去 ii.冷却过程中,溶液恢复蓝色 ⅲ.一段时间后,蓝色重又褪去 |
(1)使淀粉变蓝的物质是____。
(2)分析现象i、ii认为:在酸性条件下,加热促进淀粉水解,冷却后平衡逆向移动。
设计实验如下,“现象a”证实该分析不合理:
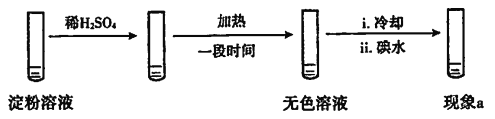
“现象a”是____。
(3)再次分析:加热后单质碘发生了变化,实验如下:
I:取少量碘水,加热至褪色,用淀粉溶液检验挥发出的物质,变蓝。
Ⅱ:向褪色后的溶液中滴加淀粉溶液,冷却过程中一直未变蓝;加入稀H2SO4,瞬间变蓝。
对步骤Ⅱ中稀H2SO4的作用,结合离子方程式,提出一种合理的解释:______________。
(4)探究碘水褪色后溶液的成分:
实验1:测得溶液的pH≈5
实验2:取褪色后的溶液,完成如下实验:
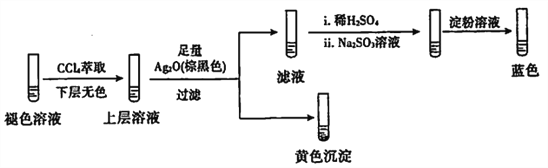
①产生黄色沉淀的离子方程式是____。
②Ag2O的作用是____________。
③依据上述实验,推测滤液中含有的物质(或离子)可能是_________。
(5)结合化学反应速率解释实验A中现象i、现象iii蓝色褪去的原因:_______________。