题目内容
【题目】硫化氢分解制取氢气和硫磺的反应原理为2H2S(g)![]() S2(g)+2H2(g),在2.0 L恒温恒容密闭容器中充入2.0 mol H2S,反应过程中的部分数据如下表所示:
S2(g)+2H2(g),在2.0 L恒温恒容密闭容器中充入2.0 mol H2S,反应过程中的部分数据如下表所示:
n/mol t/min | n(H2S) | n(S2) | n(H2) |
0 | 2.0 | 0 | 0 |
2 | 1.0 | ||
4 | 0.8 | ||
6 | 0.6 |
下列说法不正确的是( )
A.0~2min 生成H2的平均反应速率为0.25 mol·L-1·min-1
B.上述反应的平衡常数K=0.675
C.3分钟时,H2S的分解率一定小于60%
D.平衡后,向容器中通入少量O2,平衡正向移动
【答案】C
【解析】
第2min时,n(H2)=1.0mol,说明生成了1.0mol H2,则生成0.5molS2,消耗1.0molH2S;
第4min时,H2S还剩0.8mol,说明消耗了(2-0.8)molH2S,即消耗了1.2molH2S,则生成0.6molS2,生成1.2molH2;
第6min时,n(S2)=0.6mol,说明生成了0.6molS2,则生成1.2molH2,消耗1.2molH2S;
综上所述:
n/mol t/min | n(H2S) | n(S2) | n(H2) |
0 | 2.0 | 0 | 0 |
2 | 1.0 | 0.5 | 1.0 |
4 | 0.8 | 0.6 | 1.2 |
6 | 0.8 | 0.6 | 1.2 |
据此分析解答。
A.0~2min 生成1.0molH2,则v(H2)=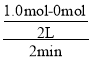 = 0.25 mol·L-1·min-1,A正确;
= 0.25 mol·L-1·min-1,A正确;
B.结合上面的分析可知,第4min到第6min,体系中各组分的物质的量不变,则4min时,反应已平衡,且平衡时H2S、S2、H2的物质的量分别为:0.8mol、0.6mol、1.2mol,因为容器体积为2.0L,则H2S、S2、H2的平衡浓度分别为:0.4mol/L、0.3mol/L、0.6mol/L,所以,平衡常数Kc=![]() =0.675,B正确;
=0.675,B正确;
C.平衡时,H2S的分解率=![]() =60%,由分析可知,无法确定3min时是否已达平衡,若3min时反应已平衡,则H2S的分解率为60%,若3min时反应未平衡,则H2S的分解率小于60%,C错误;
=60%,由分析可知,无法确定3min时是否已达平衡,若3min时反应已平衡,则H2S的分解率为60%,若3min时反应未平衡,则H2S的分解率小于60%,C错误;
D.S2为蒸汽,说明反应温度较高,向容器中通入少量O2,消耗硫磺和氢气,导致生成物浓度减小,平衡正向移动,D正确。
答案选C。

 阅读快车系列答案
阅读快车系列答案