题目内容
【题目】某化学兴趣小组测定某Fe2(SO4)3样品(只含少量FeCl2杂质)中铁元素的质量分数,按以下实验步骤进行操作:
①称取a g样品,置于烧杯中;
②加入50 mL 1.0 mol/L稀硫酸和一定量的蒸馏水,使样品溶解,然后准确配制成250.0 mL溶液;
③量取25.0 mL步骤②中配得的溶液,置于烧杯中,加入适量氯水,使反应完全;
④加入过量氨水,充分搅拌,使沉淀完全;
⑤过滤,洗涤沉淀;将沉淀转移到某容器内,加热、搅拌,直到固体由红褐色全部变为红棕色后,在干燥器中冷却至室温后,称量;
⑥……
请根据上面叙述,回答:
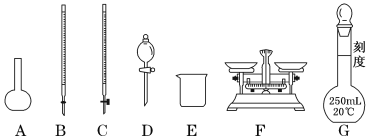
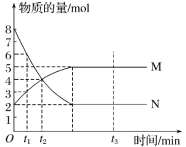
(1)上图所示仪器中,步骤①②③中必须用到的仪器有E和___________(填字母)。
(2)步骤②中:配制50 mL 1.0 mol/L稀H2SO4,需要用量筒量取98%(密度1.84 g/cm3)的浓H2SO4体积为________ mL。
(3)样品中的杂质Fe2+有较强的还原性,完成并配平下列反应的离子方程式
____Fe2++ ClO2+ === Fe3++ Cl-+ H2O
从理论上分析,上述实验中若将氯水改为ClO2时,对实验结果的影响是__________(填“偏大”“偏小”或“不影响”),等物质的量ClO2与Cl2的氧化效率之比为__________。
(4)若步骤⑤不在干燥器中冷却,则测定的铁元素的质量分数会________(填“偏大”“偏小”或“不影响”)。
【答案】CFG 2.7 5 1 4H+===5 1 2 不影响 5∶2 偏大
【解析】
根据氧化还原反应的本质和特征分析解答;根据一定物质的量浓度溶液的配制操作及注意事项分析解答;根据常用物质的制备分析解答。
(1)称量药品用天平,氯化铁和氯化亚铁的水溶液都呈酸性,所以准确量取25.00mL步骤②中配得的溶液用酸式滴定管,配制一定物质的量浓度的溶液用容量瓶,故答案为:CFG;
(2) 98%(密度1.84g/cm3)的浓H2SO4的物质的量浓度为:c(浓H2SO4)=![]() 18.4mol/L,依据稀释前后溶液溶质物质的量不变,故配制50mL,1.0mol/L稀H2SO4需要98%(密度1.84g/cm3)的浓H2SO4体积为c(浓)×V(浓)=c(稀) ×V(稀),带入计算得到:18.4mol/L× V(浓)=1.0mol/L×0.05L,即V(浓)=2.7mL,故答案为:2.7mL;
18.4mol/L,依据稀释前后溶液溶质物质的量不变,故配制50mL,1.0mol/L稀H2SO4需要98%(密度1.84g/cm3)的浓H2SO4体积为c(浓)×V(浓)=c(稀) ×V(稀),带入计算得到:18.4mol/L× V(浓)=1.0mol/L×0.05L,即V(浓)=2.7mL,故答案为:2.7mL;
(3) 反应中,Fe2+转化为Fe3+,ClO2中氯元素化合价从+4价变化为-1价,变化5价,电子转移最小公倍数为5,依据电子守恒和原子守恒配平得到离子方程式为:5Fe2++ClO2+4 H+═5Fe3++Cl-+2H2O;从理论上分析,上述实验中若将氯水改为ClO2时对实验无影响,不同的是氧化剂不同,同量还原性物质被氧化需要失去电子相同;等物质的量的ClO2与Cl2的氧化效率之比为为转移电子数之比,ClO2~Cl-~5e-,Cl2~2Cl-~2e-,所以1molClO2与Cl2的氧化效率之比为5:2,故答案为:5Fe2++ClO2+4 H+═5Fe3++Cl-+2H2O , 不影响 ,. 5∶2 ;
(4) 若步骤⑤不在干燥器中冷却,会吸收空气中的水蒸气,称量的质量增大,则测定的铁元素的质量分数偏大,故答案为:偏大。

 优加精卷系列答案
优加精卷系列答案