题目内容
7.以下物质:(1)甲烷;(2)苯;(3)聚乙烯;(4)乙醇;(5)乙炔;(6)环己烷; (7)乙酸;(8)苯乙烯(C6H5-CH=CH2).既能使KMnO4酸性溶液褪色,又能使溴水因发生化学反应而褪色的是( )| A. | (3)(5)(8) | B. | (5)(7)(8) | C. | (5)(8) | D. | (3)(5)(7)(8) |
分析 不饱和键、连接苯环支链的碳原子上含有氢原子的苯的同系物、部分醇都能被酸性高锰酸钾溶液氧化,不饱和键能和溴发生加成反应、醛基能被溴氧化,据此分析解答.
解答 解:(1)甲烷性质较稳定,和溴、高锰酸钾溶液不反应,故不选;
(2)苯性质较稳定,和溴水、高锰酸钾溶液不反应,故不选;
(3)聚乙烯中不含不饱和键,和酸性高锰酸钾、溴水不反应;
(4)乙醇能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,和溴不反应,故不选;
(5)乙炔中含有碳碳不饱和键,能被酸性高锰酸钾溶液氧化、能和溴发生加成反应,所以乙炔能使二者褪色,故选;
(6)环己烷中不含不饱和键,和酸性高锰酸钾、溴水不反应;
(7)乙酸中不含不饱和键,和酸性高锰酸钾、溴水不反应;
(8)苯乙烯(C6H5-CH=CH2)含有不饱和键,能被酸性高锰酸钾溶液氧化、能和溴发生加成反应,所以乙炔能使二者褪色,故选;
故选C.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,注意高锰酸钾溶液的强氧化性,题目难度不大,易错选项是(3).

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.下列有机物在铜催化作用下生成的物质不能发生银镜反应的是( )
| A. | 乙醇 | B. | 乙二醇 | ||
| C. | 2,2-二甲基-1-丙醇 | D. | 2-丙醇 |
18.一定条件下,在容积不变的密闭容器中,能表示反应X(g)+2Y(g)?2Z(g)一定达到化学平衡状态的是( )
①X、Y、Z的物质的量之比为1:2:2
②X、Y、Z的浓度不再发生变化
③X的正、逆反应速率相等
④单位时间内生成n mol Z,同时生成2n mol Y.
①X、Y、Z的物质的量之比为1:2:2
②X、Y、Z的浓度不再发生变化
③X的正、逆反应速率相等
④单位时间内生成n mol Z,同时生成2n mol Y.
| A. | ①② | B. | ①④ | C. | ②③ | D. | ③④ |
2.下列实验事实,不能证明苯分子中的碳碳键不是单、双键交替,而是一种介于碳碳单键与碳碳双键之间的特殊的共价键的是( )
| A. | 苯不能使酸性高锰酸钾溶液褪色 | B. | 苯的邻二氯取代产物只有一种 | ||
| C. | 苯不使溴的四氯化碳溶液褪色 | D. | 苯的对二氯取代产物只有一种 |
19.属于铝热反应的是( )
| A. | Al+HCl | B. | Al+O2 | C. | Al+MgO | D. | Al+Fe2O3 |
16.下列关于化学键的说法中不正确的是( )
| A. | 化学键是一种作用力 | |
| B. | 化学键可以使离子相结合,也可以使原子相结合 | |
| C. | 非极性键不是化学键 | |
| D. | 化学反应过程中,反应物分子内的化学键断裂,产物分子中的化学键形成 |
17.下列文字叙述与反应方程式对应且正确的是( )
| A. | 溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+=AgBr↓ | |
| B. | 用醋酸除水垢:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| C. | 利用腐蚀法制作印刷线路板:Fe3++Cu=Fe2++Cu2+ | |
| D. | 实验室用溴和苯在催化剂作用下制溴苯: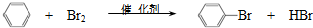 |
 ⑥CH3CH2CH2CH(CH3)C2H5
⑥CH3CH2CH2CH(CH3)C2H5 ⑧
⑧ ⑨
⑨
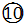
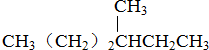
 O2
O2 ${\;}_{17}^{35}$Cl
${\;}_{17}^{35}$Cl  O3
O3  ${\;}_{17}^{37}$Cl
${\;}_{17}^{37}$Cl  ;
; ;
; .
.