题目内容
【题目】在T℃时,发生反应C(s)+H2O(g)![]() CO(g)+H2(g)
CO(g)+H2(g)
(1)恒温时,在一个2L的密闭容器中加入4molC 和1molH2O(g),5min后反应达到平衡,C 的转化率为20%。
①0~5min 内,用H2O(g)表示的平均反应速率为_________。
②有关该反应下列说法正确的是_________。
a.容器中压强不变或混合气体密度不变均可以判定该反应已经达到平衡状态
b.若将加入的碳块改为碳粉,则能够提高水蒸气的平衡转化率
c.平衡后,再加入0 .5molC、5mol H2O(g)、2molCO、2molH2,平衡不移动
(2)已知:Ⅰ.破坏1mol 共价键所需要的能量如下表:
共价键 | 石墨中的碳碳键 | H-H | C | H-O |
能量/kJ | 475.7 | 436 | 1072 | 463 |
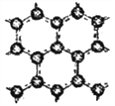
Ⅱ.石墨层由六角形蜂巢结构的碳原子构成,如右图所示,已知每个碳原子形成的共价键数为1.5NA。
某同学构想:通过下图所示装置实现C(s)+H2O(g)![]() CO(g)+H2(g)的反应。
CO(g)+H2(g)的反应。
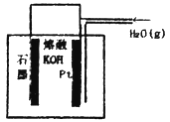
①按该考生的构想,石墨电极发生的反应式为_______________________。
②请用计算判断该构想的合理性:______________________。
【答案】 0.08mol/(L·min) a C-2e-+2OH-=CO↑+H2O 该反应的焓变为: △H=1.5×475.7kJ+2×463 kJ-1072kJ-436kJ=+131.5kJ>0,说明是吸热反应,不能将化学能转化为电能,因此该构想不合理
【解析】(1) C(s)+H2O(g)![]() CO(g)+H2(g)
CO(g)+H2(g)
起始(mol)4 1 0 0
反应(mol)0.8 0.8 0.8 0.8
平衡(mol) 0.2 0.8 0.8
①5min后反应达到平衡,C的转化率为20%,反应的C为4mol×20%=0.8mol,则反应的H2O为0.8mol,v(H2O)= 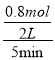 = 0.08mol/(L·min),故答案为:0.08mol/(L·min);
= 0.08mol/(L·min),故答案为:0.08mol/(L·min);
②a.该反应为气体的物质的量变化的反应,气体的质量也发生变化,容器中压强不变或混合气体密度不变均可以判定该反应已经达到平衡状态,故a正确;b.若将加入的碳块改为碳粉,能够加快反应速率,但不会改变平衡,水蒸气的平衡转化率不变,故b错误;c.平衡常数K=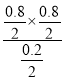 =1.6,Qc=
=1.6,Qc=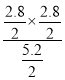 <K=1.6,平衡一定发生移动,故c错误;故选a;
<K=1.6,平衡一定发生移动,故c错误;故选a;
(2)①根据图示,反应的总反应为C(s)+H2O(g)![]() CO(g)+H2(g),则石墨电极为负极,发生氧化反应,反应式为C-2e-+2OH-=CO↑+H2O,故答案为:C-2e-+2OH-=CO↑+H2O;
CO(g)+H2(g),则石墨电极为负极,发生氧化反应,反应式为C-2e-+2OH-=CO↑+H2O,故答案为:C-2e-+2OH-=CO↑+H2O;
②根据表格数据,该反应的焓变为:△H=1.5×475.7kJ+2×463kJ-1072kJ-436kJ=+131.5kJ>0,说明是吸热反应,不能将化学能转化为电能,因此该构想不合理,故答案为:该反应的焓变为:△H=1.5×475.7kJ+2×463kJ-1072kJ-436kJ=+131.5kJ>0,说明是吸热反应,不能将化学能转化为电能,因此该构想不合理。

 小学教材完全解读系列答案
小学教材完全解读系列答案【题目】用下列实验装置完成对应的实验,能达到实验目的的是
实验装置 |
|
|
|
|
实验目的 | 实验验证浓硫酸具有脱水性、氧化性 | 制取并收集少量氨气 | 验证NaHCO3和Na2CO3的热稳定性 | 采用CCl4萃取I2 |
A | B | C | D |
A. A B. B C. C D. D