题目内容
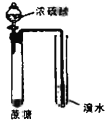
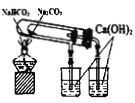
【题目】用下列实验装置完成对应的实验,能达到实验目的的是
实验装置 |
|
|
|
|
实验目的 | 实验验证浓硫酸具有脱水性、氧化性 | 制取并收集少量氨气 | 验证NaHCO3和Na2CO3的热稳定性 | 采用CCl4萃取I2 |
A | B | C | D |
A. A B. B C. C D. D
【答案】A
【解析】A项,将浓硫酸滴入盛有蔗糖的试管中可观察到蔗糖变黑,证明浓H2SO4具有脱水性,盛溴水的试管中可观察到橙色褪为无色,说明浓H2SO4与蔗糖作用产生了SO2,浓H2SO4被还原成SO2,证明浓H2SO4具有氧化性,A项正确;B项,浓氨水滴入生石灰中可产生NH3,反应方程式为CaO+NH3·H2O=Ca(OH)2+NH3↑,收集试管口使用橡胶塞不能排出空气,同时装置中气压过大使试管破裂,B项错误;C项,Na2CO3比NaHCO3稳定,应将Na2CO3盛放在外试管中,NaHCO3盛放在内试管中验证NaHCO3和Na2CO3的热稳定性,C项错误;D项,用CCl4从碘水中萃取I2,振荡时应将分液漏斗倒转过来,D项错误;答案选A。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】在T℃时,发生反应C(s)+H2O(g)![]() CO(g)+H2(g)
CO(g)+H2(g)
(1)恒温时,在一个2L的密闭容器中加入4molC 和1molH2O(g),5min后反应达到平衡,C 的转化率为20%。
①0~5min 内,用H2O(g)表示的平均反应速率为_________。
②有关该反应下列说法正确的是_________。
a.容器中压强不变或混合气体密度不变均可以判定该反应已经达到平衡状态
b.若将加入的碳块改为碳粉,则能够提高水蒸气的平衡转化率
c.平衡后,再加入0 .5molC、5mol H2O(g)、2molCO、2molH2,平衡不移动
(2)已知:Ⅰ.破坏1mol 共价键所需要的能量如下表:
共价键 | 石墨中的碳碳键 | H-H | C | H-O |
能量/kJ | 475.7 | 436 | 1072 | 463 |
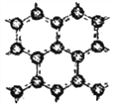
Ⅱ.石墨层由六角形蜂巢结构的碳原子构成,如右图所示,已知每个碳原子形成的共价键数为1.5NA。
某同学构想:通过下图所示装置实现C(s)+H2O(g)![]() CO(g)+H2(g)的反应。
CO(g)+H2(g)的反应。
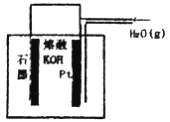
①按该考生的构想,石墨电极发生的反应式为_______________________。
②请用计算判断该构想的合理性:______________________。
【题目】氢叠氮酸(HN3)和莫尔盐(NH4)2SO4·FeSO4·6H2O是两种常用原料。
(1)氨叠氮酸易溶于水,25℃时,该酸的电离常数为Ka=10×10-5
①氢叠氮酸在水溶液中的电离方程式为________________________________
②0.2mol/L的HN3溶液与0.1mol/L的NaOH溶液等体积混合后,恢复到25℃,混合溶液中各离子和HN3分子浓度由大到小的顺序为__________________________。
③已知T℃时,Ksp(CuN3)=5.0×10-9,Ksp(Cu2S)=2.5×10-48,则相同温度下,2CuN3(s)+S2-(aq)![]() Cu2S(s)+2N3-(aq)该反应正反应方向_________(“能”或“不能”)进行基本彻底,请通过计算说明_________________________。
Cu2S(s)+2N3-(aq)该反应正反应方向_________(“能”或“不能”)进行基本彻底,请通过计算说明_________________________。
(2)在FeSO4溶液中,加入(NH4)2SO4固体可制备莫尔盐晶体,为了测定产品纯度,称取ag产品溶于水,配制成500mL溶液,用浓度为cmol/L的酸性高锰酸钾溶液滴定,每次所取待测液体积均为25.00mL,实验结果记录如下:(已知莫尔盐的分子量为392)
实验次数 | 第一次 | 第二次 | 第三次 |
消耗KMnO4溶液体积/mL | 25.52 | 25.02 | 24.98 |
滴定终点的现象是________________,通过实验数据,计算该产品的纯度为_________(用含字母a、c的式子表示)。上表第一次实验中记录数据明显大于后两次,其原因可能是_________。
A.第一次滴定时,锥形瓶用待装液润洗
B.该酸性高锰酸钾标准液保存时间过长,部分变质
C.滴定前酸式滴定管中尖嘴处有气泡,滴定结束后气泡消失
【题目】高锰酸钾是常用的氧化剂。某化学小组在实验室以软锰矿(主要成分是MnO2)为原料制备KMnO4,下图是实验室制备高锰酸钾的操作流程。
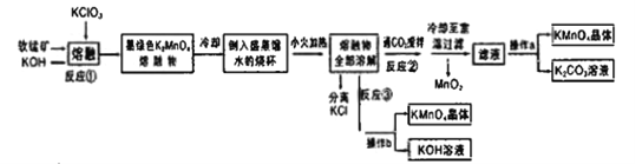
已知:
温度 | 溶解度/g | ||
K2CO3 | KHCO3 | KMnO4 | |
20℃ | 111 | 33.7 | 6.38 |
请回答:
(1)反应①的化学方程式为______。加热软锰矿、KClO3、和KOH固体时,除三脚架、玻璃棒、泥三角和铁坩埚外,还用到的仪器有_____,不采用瓷坩埚而选用铁坩埚的理由是________。
(2)反应②中氧化产物与还原产物的物质的量之比为________;上述流程中可以循环利用的物质是__________
(3)实验时,从滤液中得到KMnO4晶体的实验操作a为_____。若CO2过量会生成KHCO3导致得到的KMnO4产品的纯度降低其原因是_________
(4)反应③是模拟工业上采用惰性电极电解法制取高锰酸钾晶体,写出反应的化学方程式_____。
【题目】碳、氮及其化合物与生活密切相关。请根据要求回答下列问题:
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H= —574kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H= —1160kJ/mol
③H2O(g)=H2O(l) △H= —44kJ/mol
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(1)的热化学方程式_________。
(2)已知:反应I:4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g) △H<0
4NO(g)+6H2O(g) △H<0
反应II:4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) △H<0
2N2(g)+6H2O(g) △H<0
①在恒温恒容装置中充入一定量的NH3和O2,在催化剂的作用下进行反应I,则下列有关叙述中正确的是___(填字母序号)。
A.增大压强,Kp(用压强表示的化学平衡常数)增大
B.若测得容器内3v(NH3)=2v (H2O)时,说明反应已达平衡
C.通入一定量的氮气,则化学反应速率增大
D.达到平衡时体系的压强不再变化
②氨催化氧化时会发生上述两个竞争反应I、II。为分析某催化剂对该反应的选择性,在1L密闭容器中充入1molNH3和2molO2,得有关物质的量关系如图,该催化剂在低温时选择反应_____(填“I”或“II”)。
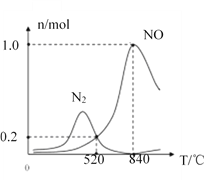
③520℃时,4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g)的平衡常数K=_______(只需列出数字计算式,无需化简)。恒压容器中,为了提高NH3转化为N2平衡转化率的措施有______(填字母序号)
2N2(g)+6H2O(g)的平衡常数K=_______(只需列出数字计算式,无需化简)。恒压容器中,为了提高NH3转化为N2平衡转化率的措施有______(填字母序号)
A.降低反应温度 B. 投料比不变,增加反应物的浓度
C.增大NH3和O2的初始投料比 D. 充入一定量的氦气
(3)己知25℃时HCN和H2CO3的电离常数(Ka.)如下表:
物质 | 电离常数(Ka) |
HCN | Ka=5×10-10 |
H2CO3 | Ka1=4.5×10-7;Ka2=4.7×10-11 |
25℃时,测得等体积等浓度的HCN和NaCN的混合溶液pH=11,则c(Na+)、c(H+)、c(CN—)、c(OH—)、c(HCN)浓度由大到小顺序为______,向NaCN溶液中通入少量CO2,则发生反应的化学方程式为:______________________。