题目内容
【题目】a、b、c、d四个集气瓶中装有Cl2、H2、HCl、HBr中的任一种气体,若a、d两瓶气体混合后强光照射下发生爆炸,a、b两瓶气体相混,瓶壁上出现红棕色液滴,则a、b、c、d四瓶中气体应是( )
A.Cl2、HBr、HCl、H2
B.Cl2、HCl、HBr、H2
C.H2、HBr、HCl、Cl2
D.H2、HCl、HBr、Cl2
【答案】A
【解析】解:a、d两瓶气体混合后强光照射下发生爆炸,说明a、d为H2和Cl2;a、b两瓶气体相混,瓶壁上出现红棕色液滴,说明a、b为Cl2和HBr;故a为Cl2 , d为H2 , b为HBr,c为HCl, 故选A.

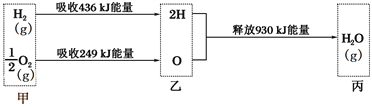
【题目】在T℃时,发生反应C(s)+H2O(g)![]() CO(g)+H2(g)
CO(g)+H2(g)
(1)恒温时,在一个2L的密闭容器中加入4molC 和1molH2O(g),5min后反应达到平衡,C 的转化率为20%。
①0~5min 内,用H2O(g)表示的平均反应速率为_________。
②有关该反应下列说法正确的是_________。
a.容器中压强不变或混合气体密度不变均可以判定该反应已经达到平衡状态
b.若将加入的碳块改为碳粉,则能够提高水蒸气的平衡转化率
c.平衡后,再加入0 .5molC、5mol H2O(g)、2molCO、2molH2,平衡不移动
(2)已知:Ⅰ.破坏1mol 共价键所需要的能量如下表:
共价键 | 石墨中的碳碳键 | H-H | C | H-O |
能量/kJ | 475.7 | 436 | 1072 | 463 |
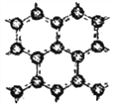
Ⅱ.石墨层由六角形蜂巢结构的碳原子构成,如右图所示,已知每个碳原子形成的共价键数为1.5NA。
某同学构想:通过下图所示装置实现C(s)+H2O(g)![]() CO(g)+H2(g)的反应。
CO(g)+H2(g)的反应。
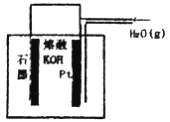
①按该考生的构想,石墨电极发生的反应式为_______________________。
②请用计算判断该构想的合理性:______________________。
【题目】氢叠氮酸(HN3)和莫尔盐(NH4)2SO4·FeSO4·6H2O是两种常用原料。
(1)氨叠氮酸易溶于水,25℃时,该酸的电离常数为Ka=10×10-5
①氢叠氮酸在水溶液中的电离方程式为________________________________
②0.2mol/L的HN3溶液与0.1mol/L的NaOH溶液等体积混合后,恢复到25℃,混合溶液中各离子和HN3分子浓度由大到小的顺序为__________________________。
③已知T℃时,Ksp(CuN3)=5.0×10-9,Ksp(Cu2S)=2.5×10-48,则相同温度下,2CuN3(s)+S2-(aq)![]() Cu2S(s)+2N3-(aq)该反应正反应方向_________(“能”或“不能”)进行基本彻底,请通过计算说明_________________________。
Cu2S(s)+2N3-(aq)该反应正反应方向_________(“能”或“不能”)进行基本彻底,请通过计算说明_________________________。
(2)在FeSO4溶液中,加入(NH4)2SO4固体可制备莫尔盐晶体,为了测定产品纯度,称取ag产品溶于水,配制成500mL溶液,用浓度为cmol/L的酸性高锰酸钾溶液滴定,每次所取待测液体积均为25.00mL,实验结果记录如下:(已知莫尔盐的分子量为392)
实验次数 | 第一次 | 第二次 | 第三次 |
消耗KMnO4溶液体积/mL | 25.52 | 25.02 | 24.98 |
滴定终点的现象是________________,通过实验数据,计算该产品的纯度为_________(用含字母a、c的式子表示)。上表第一次实验中记录数据明显大于后两次,其原因可能是_________。
A.第一次滴定时,锥形瓶用待装液润洗
B.该酸性高锰酸钾标准液保存时间过长,部分变质
C.滴定前酸式滴定管中尖嘴处有气泡,滴定结束后气泡消失
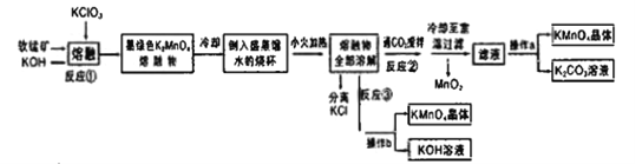
【题目】高锰酸钾是常用的氧化剂。某化学小组在实验室以软锰矿(主要成分是MnO2)为原料制备KMnO4,下图是实验室制备高锰酸钾的操作流程。
已知:
温度 | 溶解度/g | ||
K2CO3 | KHCO3 | KMnO4 | |
20℃ | 111 | 33.7 | 6.38 |
请回答:
(1)反应①的化学方程式为______。加热软锰矿、KClO3、和KOH固体时,除三脚架、玻璃棒、泥三角和铁坩埚外,还用到的仪器有_____,不采用瓷坩埚而选用铁坩埚的理由是________。
(2)反应②中氧化产物与还原产物的物质的量之比为________;上述流程中可以循环利用的物质是__________
(3)实验时,从滤液中得到KMnO4晶体的实验操作a为_____。若CO2过量会生成KHCO3导致得到的KMnO4产品的纯度降低其原因是_________
(4)反应③是模拟工业上采用惰性电极电解法制取高锰酸钾晶体,写出反应的化学方程式_____。