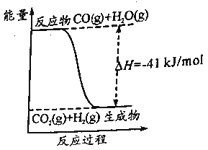
题目内容
【题目】氮及其化合物的转化是资源利用和环境保护的重要研究课题。
(1)合成氨工业是最基本的无机化工之一,氨是化肥工业和基本有机化工的主要原料。合成氨反应中有关化学键键能数据如下表:
化学键 | H—H | N≡N | N—H |
E/kJmol-1 | 436 | 946 | 391 |
①已知:合成氨反应:N2(g)+3H2(g)![]() 2NH3(g)的活化能Ea=508kJmol-1,则氨分解反应:NH3(g)
2NH3(g)的活化能Ea=508kJmol-1,则氨分解反应:NH3(g)![]()
![]() N2(g)+
N2(g)+![]() H2(g)的活化能Ea=_____。
H2(g)的活化能Ea=_____。
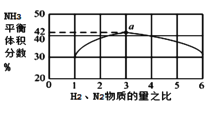
②图1表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据如图中a点数据计算N2的平衡体积分数:_____(保留3位有效数字)。
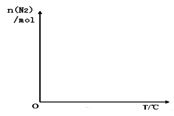
③依据温度对合成氨反应的影响,在如图坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,N2物质的量变化的曲线示意图_____。
(2)选择性催化还原脱硝技术(SCR)是目前较成熟的烟气脱硝技术,该技术是指在温度300~420℃之间和催化剂条件下,用还原剂(如NH3)选择性地与NOx反应。
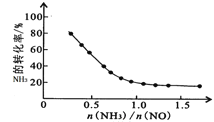
①SCR脱硝技术中发生的主要反应为:4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g) △H=-1625.5kJmol-1;氨氮比
4N2(g)+6H2O(g) △H=-1625.5kJmol-1;氨氮比![]() 会直接影响该方法的脱硝率。350℃时,只改变氨气的投放量,氨气的转化率与氨氮比的关系如图所示。当
会直接影响该方法的脱硝率。350℃时,只改变氨气的投放量,氨气的转化率与氨氮比的关系如图所示。当![]() >1.0时,烟气中NO浓度反而增大,主要原因是_____。
>1.0时,烟气中NO浓度反而增大,主要原因是_____。
②碱性溶液处理烟气中的氮氧化物也是一种脱硝的方法,写出NO2被Na2CO3溶液吸收生成三种盐的化学反应方程式_____。
【答案】300kJmol-1 14.5%或0.145 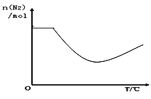 过量氨气与氧气反应生成NO 2NO2+2Na2CO3+H2O=NaNO3+NaNO2+2NaHCO3
过量氨气与氧气反应生成NO 2NO2+2Na2CO3+H2O=NaNO3+NaNO2+2NaHCO3
【解析】
⑴①先根据化学键能计算焓变,焓变又等于正反应活化能减去逆反应活化能,注意可逆反应方程式变化;②图1表示500℃、60.0MPa条件下,假设放入1mol N2,3mol H2,建立三段式进行计算;③依据温度对合成氨反应的影响,从通入原料气开始,随温度不断升高,N2物质的量先不变,当温度达到反应温度时,开始反应,不断减小,建立平衡,温度继续增加,平衡逆向移动,氮气物质的量增加。
⑵①4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g),反应中有氧气参与反应,当
4N2(g)+6H2O(g),反应中有氧气参与反应,当![]() >1.0时,烟气中NO浓度反而增大,剩余氨气,氨气可能与氧气反应生成NO;②NO2被Na2CO3溶液吸收生成三种盐,NO2中氮化合价既升高又降低,形成两种盐NaNO3和NaNO2,则另一种盐则为碳酸氢钠。
>1.0时,烟气中NO浓度反而增大,剩余氨气,氨气可能与氧气反应生成NO;②NO2被Na2CO3溶液吸收生成三种盐,NO2中氮化合价既升高又降低,形成两种盐NaNO3和NaNO2,则另一种盐则为碳酸氢钠。
⑴①已知:合成氨反应:N2(g)+3H2(g)![]() 2NH3(g)的活化能Ea=508kJmol-1,
2NH3(g)的活化能Ea=508kJmol-1,
ΔH = 946 kJmol1 + 3×436kJmol1 6×391 kJmol1 = 92 kJmol1,ΔH = Ea – E(逆) = 92 kJmol1,E(逆) = Ea 92 kJmol1= 600 kJmol1,则氨分解反应:NH3(g)![]()
![]() N2(g)+
N2(g)+![]() H2(g)的活化能Ea = 300 kJmol1;故答案为:300 kJmol1。
H2(g)的活化能Ea = 300 kJmol1;故答案为:300 kJmol1。
②图1表示500℃、60.0MPa条件下,假设放入1mol N2,3mol H2,
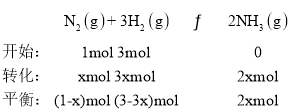
![]() ,解得x = 0.592,a点数据计算N2的平衡体积分数
,解得x = 0.592,a点数据计算N2的平衡体积分数![]() ,故答案为14.5%。
,故答案为14.5%。
③依据温度对合成氨反应的影响,从通入原料气开始,随温度不断升高,N2物质的量先不变,当温度达到反应温度时,开始反应,不断减小,建立平衡,温度继续增加,平衡逆向移动,氮气物质的量增加,其变化的曲线示意图为 ;故答案为:
;故答案为: 。
。
⑵①4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g),氧气参与了反应,当
4N2(g)+6H2O(g),氧气参与了反应,当![]() >1.0时,烟气中NO浓度反而增大,剩余氨气,氨气可能与氧气反应生成NO,故答案为:过量氨气与氧气反应生成NO。
>1.0时,烟气中NO浓度反而增大,剩余氨气,氨气可能与氧气反应生成NO,故答案为:过量氨气与氧气反应生成NO。
②NO2被Na2CO3溶液吸收生成三种盐,NO2中氮化合价既升高又降低,形成两种盐NaNO3和NaNO2,则另一种盐则为碳酸氢钠,因此化学反应方程式2NO2+2Na2CO3+H2O = NaNO3+NaNO2+2NaHCO3;故答案为:2NO2+2Na2CO3+H2O=NaNO3+NaNO2+2NaHCO3。