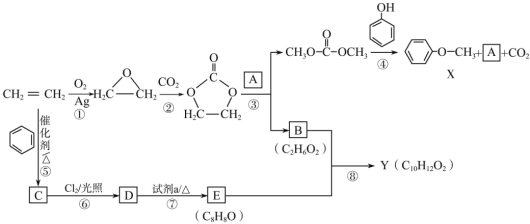
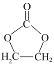
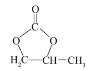
题目内容
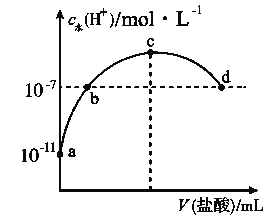
【题目】常温下,向20 mL 0.1 mol·L-1氨水中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示。则下列说法不正确的是( )
A. 常温下,0.1 mol·L-1氨水中![]() 的电离常数
的电离常数![]() 约为
约为![]()
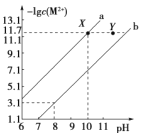
B. a、b之间的点一定满足:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
C. c点溶液中c(NH4+)<c(Cl-)
D. b点代表溶液呈中性
【答案】B
【解析】
A.常温下,0.1mol/L的氨水溶液中c(H+)=10-11mol/L,则c(OH-)=1014/1011mol/L=0.001mol/L,结合Kb=c(NH4+)c(OH)/c(NH3H2O)计算;
B.a、b之间的任意一点,溶液都呈碱性,结合电荷守恒判断离子浓度大小;
C.根据图知,c点水电离出的氢离子浓度最大,恰好反应生成氯化铵;
D. b点溶液中c点水电离出的c(H+)=10-7mol/L,常温下c(H+)·c(OH-)=Kw=10-14,据此判断。
A.常温下,0.1mol/L的氨水溶液中c(H+)=10-11mol/L,则c(OH-)=1014/1011mol/L=0.001mol/L,Kb=c(NH4+)c(OH)/c(NH3H2O)=103×103/0.1mol/L=1×10-5mol/L,故A正确;
B.a、b之间的任意一点,溶液都呈碱性,则c(H+)<c(OH-),结合电荷守恒得c(Cl-)<c(NH4+),而c(Cl-)和c(OH-)的相对大小与所加盐酸的量有关,故B错误;
C.根据图知,c点水电离出的氢离子浓度最大,恰好反应生成氯化铵,铵根水解溶液呈酸性,结合电荷守恒得:c(NH4+)<c(Cl-),故C正确;
D.b点溶液中c(H+)=10-7mol/L,常温下c(H+)·c(OH-)=Kw=10-14,所以c(H+)=c(OH-),溶液呈中性,故D正确。
故选B。

 全能练考卷系列答案
全能练考卷系列答案【题目】氮及其化合物的转化是资源利用和环境保护的重要研究课题。
(1)合成氨工业是最基本的无机化工之一,氨是化肥工业和基本有机化工的主要原料。合成氨反应中有关化学键键能数据如下表:
化学键 | H—H | N≡N | N—H |
E/kJmol-1 | 436 | 946 | 391 |
①已知:合成氨反应:N2(g)+3H2(g)![]() 2NH3(g)的活化能Ea=508kJmol-1,则氨分解反应:NH3(g)
2NH3(g)的活化能Ea=508kJmol-1,则氨分解反应:NH3(g)![]()
![]() N2(g)+
N2(g)+![]() H2(g)的活化能Ea=_____。
H2(g)的活化能Ea=_____。
②图1表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据如图中a点数据计算N2的平衡体积分数:_____(保留3位有效数字)。
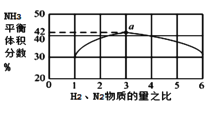
③依据温度对合成氨反应的影响,在如图坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,N2物质的量变化的曲线示意图_____。
(2)选择性催化还原脱硝技术(SCR)是目前较成熟的烟气脱硝技术,该技术是指在温度300~420℃之间和催化剂条件下,用还原剂(如NH3)选择性地与NOx反应。
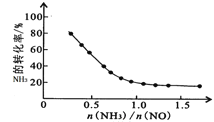
①SCR脱硝技术中发生的主要反应为:4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g) △H=-1625.5kJmol-1;氨氮比
4N2(g)+6H2O(g) △H=-1625.5kJmol-1;氨氮比![]() 会直接影响该方法的脱硝率。350℃时,只改变氨气的投放量,氨气的转化率与氨氮比的关系如图所示。当
会直接影响该方法的脱硝率。350℃时,只改变氨气的投放量,氨气的转化率与氨氮比的关系如图所示。当![]() >1.0时,烟气中NO浓度反而增大,主要原因是_____。
>1.0时,烟气中NO浓度反而增大,主要原因是_____。
②碱性溶液处理烟气中的氮氧化物也是一种脱硝的方法,写出NO2被Na2CO3溶液吸收生成三种盐的化学反应方程式_____。