题目内容
【题目】某化学兴趣小组对某黄铁矿石(主要成分为FeS2)进行如下实验探究。
实验一:测定硫元素的含量
I.将m1 g该黄铁矿样品放入如图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全,得到红棕色固体和一种刺激性气味的气体。
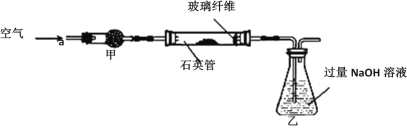
Ⅱ.反应结束后,将乙瓶中的溶液进行如下处理:
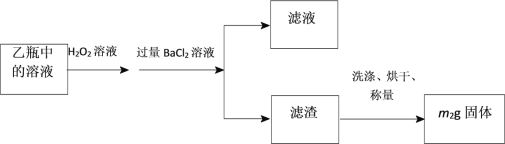
问题与讨论:
(1)石英管中发生反应的化学方程式为_________。
(2)I中,干燥管甲内所盛试剂是________,石英管中的玻璃纤维的作用为__________。
(3)该黄铁矿石中硫元素的质量分数为___________。
实验二:测定铁元素的含量

问题与讨论:
(4)步骤②中,若选用铁粉作还原剂,会使测量结果________(填“不影响”、“偏高”或“偏低”)。
(5)步骤③中,需要用到的玻璃仪器有烧杯、玻璃棒、_______、________。
(6)滴定终点的现象是___。
(7)用c mol/LKMnO4溶液滴定,终点时消耗KMnO4溶液V mL,则黄铁矿中铁元素的质量分数为___。
【答案】4FeS2+11O2![]() 2Fe2O3+8SO2 碱石灰(或氢氧化钠固体或氧化钙固体) 防止气流把固体吹到导管内堵塞导管
2Fe2O3+8SO2 碱石灰(或氢氧化钠固体或氧化钙固体) 防止气流把固体吹到导管内堵塞导管 ![]() ×100% 偏高 250 mL容量瓶 胶头滴管 溶液变成粉红色且半分钟内不变色
×100% 偏高 250 mL容量瓶 胶头滴管 溶液变成粉红色且半分钟内不变色 ![]() ×100%
×100%
【解析】
(1)石英管中发生反应是高温下FeS2被氧气氧化成SO2和Fe2O3;
(2)甲中使用固体干燥剂,用于除掉空气中的水分,所以选用碱石灰;玻璃纤维可防止固体进入导气管;
(3)根据硫原子守恒计算硫铁矿中硫的质量,从而计算其质量分数;
(4)铁和铁离子反应生成的亚铁离子物质的量增大;若将稀释液久置,溶液中的亚铁离子部分被氧化成铁离子;
(5)根据一定物质的量浓度溶液的配制中需使用的仪器完成;
(6)酸性高锰酸钾溶液氧化亚铁离子生成铁离子。
(1)高温下,FeS2被氧气氧化成SO2和Fe2O3,根据电子守恒、原子守恒,可得配平后的化学方程式为:4FeS2+11O2![]() 2Fe2O3+8SO2;
2Fe2O3+8SO2;
(2)由于甲装置需要使用固体干燥剂,用于除掉空气中的水分,可以选用碱石灰(或氢氧化钠固体或氧化钙固体),石英管右端的玻璃纤维的作用为防止气流把固体吹到导管内堵塞导管;
(3)最终所得沉淀是硫酸钡,根据硫原子守恒得硫的质量,n(BaSO4)=![]() =
=![]() mol,则其中含有的S元素的质量为m(S)=n·M=
mol,则其中含有的S元素的质量为m(S)=n·M=![]() mol×32 g/mol=
mol×32 g/mol=![]() g,所以该黄铁矿石中硫元素的质量分数为
g,所以该黄铁矿石中硫元素的质量分数为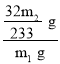 ×100%=
×100%=![]() ×100%;
×100%;
(4)铁和铁离子会发生反应:Fe+2Fe3+=3Fe2+,反应生成的Fe2+,使溶液中Fe2+物质的量增大,使反应消耗高锰酸钾物质的量增大,导致测定结果偏高;
(5)在配制一定体积一定物质的量浓度溶液中,使用的仪器除了烧杯、玻璃棒外,还需要250mL容量瓶、胶头滴管;
(6)用KMnO4酸性溶液滴定Fe2+,当Fe2+恰好完全被氧化为Fe3+,再滴入KMnO4酸性溶液,溶液就会变成粉红色且半分钟内不变色,说明达到滴定终点;
(7)25.00 mL溶液反应消耗KMnO4溶液的物质的量n(KMnO4)=c mol/L×V ×10-3 L=cV×10-3 mol,根据电子守恒可知溶液中Fe2+的物质的量为n(Fe2+)=5n(KMnO4)=5cV×10-3 mol,其质量m(Fe) =n(Fe2+)M=5cV×10-3 mol×56 g/mol,所以原溶液中含有Fe元素的质量m(Fe)=![]() 5cV×10-3 mol×56 g/mol=
5cV×10-3 mol×56 g/mol=![]() ×100%=
×100%=![]() ×100%。
×100%。

 小题狂做系列答案
小题狂做系列答案【题目】氮及其化合物的转化是资源利用和环境保护的重要研究课题。
(1)合成氨工业是最基本的无机化工之一,氨是化肥工业和基本有机化工的主要原料。合成氨反应中有关化学键键能数据如下表:
化学键 | H—H | N≡N | N—H |
E/kJmol-1 | 436 | 946 | 391 |
①已知:合成氨反应:N2(g)+3H2(g)![]() 2NH3(g)的活化能Ea=508kJmol-1,则氨分解反应:NH3(g)
2NH3(g)的活化能Ea=508kJmol-1,则氨分解反应:NH3(g)![]()
![]() N2(g)+
N2(g)+![]() H2(g)的活化能Ea=_____。
H2(g)的活化能Ea=_____。
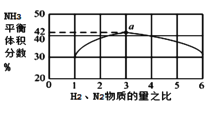
②图1表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据如图中a点数据计算N2的平衡体积分数:_____(保留3位有效数字)。
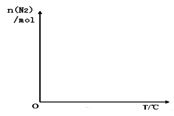
③依据温度对合成氨反应的影响,在如图坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,N2物质的量变化的曲线示意图_____。
(2)选择性催化还原脱硝技术(SCR)是目前较成熟的烟气脱硝技术,该技术是指在温度300~420℃之间和催化剂条件下,用还原剂(如NH3)选择性地与NOx反应。
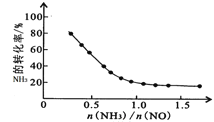
①SCR脱硝技术中发生的主要反应为:4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g) △H=-1625.5kJmol-1;氨氮比
4N2(g)+6H2O(g) △H=-1625.5kJmol-1;氨氮比![]() 会直接影响该方法的脱硝率。350℃时,只改变氨气的投放量,氨气的转化率与氨氮比的关系如图所示。当
会直接影响该方法的脱硝率。350℃时,只改变氨气的投放量,氨气的转化率与氨氮比的关系如图所示。当![]() >1.0时,烟气中NO浓度反而增大,主要原因是_____。
>1.0时,烟气中NO浓度反而增大,主要原因是_____。
②碱性溶液处理烟气中的氮氧化物也是一种脱硝的方法,写出NO2被Na2CO3溶液吸收生成三种盐的化学反应方程式_____。