题目内容
【题目】CaS用于制备除虫剂、发光材料等。某课题组拟用硫酸钙和焦炭在高温下反应制备硫化钙并检验产物。
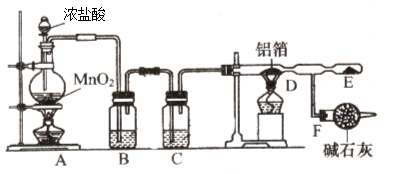
(1)甲同学设计如图实验装置检验气体产物:
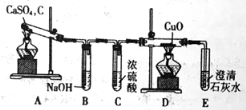
①B装置作用是 ;
②D和E装置能检验装置A的反应产物是 ;
③E装置中可能出现的现象是 。
(2)乙同学提出,根据氧化还原反应,A中的气体产物可能还有CO2、SO2,为了验证他的猜想,结合上述装置并选择下列仪器设计方案(同一种仪器可重复使用)。
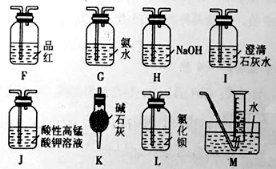
①气流从左至右,仪器连接顺序为A、F 。
②能证明有SO2的现象是 ;能证明有CO2的现象是 。
③除去SO2的离子方程式为 。
(3)经试验检验气体产物有SO2、CO、CO2且气体体积之比为1:1:2,写出A中反应的化学方程式 。
(4)利用重量法测定固体产物的质量之比,即将样品溶于足量的饱和碳酸钠溶液,过滤洗涤、干燥等。需要测定的物理量有 。(已知CaS与H2O反应生成Ca(OH)2和H2S)
【答案】(1)①除去酸性气体;②CO;③溶液变浑浊;
(2)①J、F、I、M
②第1个F中溶液褪色;第2个F中溶液不褪色,I中溶液变浑浊
③5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+
(3)2CaSO4+3C![]() CaS+CaO+SO2↑+2CO2↑+CO↑
CaS+CaO+SO2↑+2CO2↑+CO↑
(4)样品的质量、碳酸钙的质量
【解析】
试题分析:(1)①用硫酸钙和焦炭在高温下反应制备硫化钙,根据质量守恒定律,产物中会生成二氧化碳等酸性气体,可以通过氢氧化钠溶液吸收除去,故答案为:除去酸性气体;
②生成的气体中可能含有一氧化碳等还原性气体,加热时,一氧化碳能够还原氧化铜,故答案为:CO;
③如果存在一氧化碳,则气体通过装置D生成二氧化碳,二氧化碳能够使澄清石灰水变浑浊,故答案为:溶液变浑浊;
(2)①检验气体产物可能还有CO2、SO2,可以通过品红溶液检验二氧化硫,除去二氧化硫后再用澄清石灰水检验二氧化碳,气流从左至右,仪器连接顺序为A、F 、J、F、I、M,故答案为:J、F、I、M;
②能证明有SO2的现象是第1个F中溶液褪色;能证明有CO2的现象是第2个F中溶液不褪色,I中溶液变浑浊,故答案为:第1个F中溶液褪色;第2个F中溶液不褪色,I中溶液变浑浊;
③二氧化硫与高锰酸钾发生氧化还原反应,反应的离子方程式为5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+,故答案为:5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+;
(3)气体产物有SO2、CO、CO2且气体体积之比为1:1:2,反应的化学方程式为2CaSO4+3C![]() CaS+CaO+SO2↑+2CO2↑+CO↑,故答案为:2CaSO4+3C
CaS+CaO+SO2↑+2CO2↑+CO↑,故答案为:2CaSO4+3C![]() CaS+CaO+SO2↑+2CO2↑+CO↑;
CaS+CaO+SO2↑+2CO2↑+CO↑;
(4)将样品溶于足量的饱和碳酸钠溶液,过滤洗涤、干燥,利用重量法测定固体产物的质量之比,需要测定的物理量有样品的质量、碳酸钙的质量,故答案为:样品的质量、碳酸钙的质量。