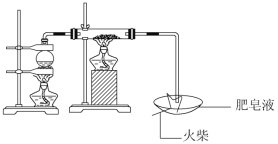
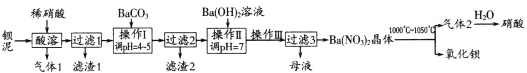
题目内容
【题目】物质A、B、C、D、E、F、G、H、I、J、K存在下图转化关系,其中气体D、E为单质,试回答:
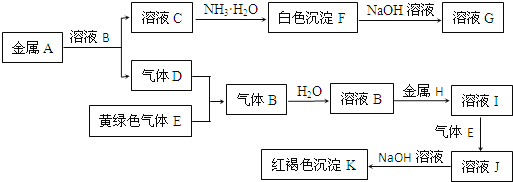
(1)写出下列物质的化学式:
A是_______________,D是___________,K是_______________。
(2)写出反应“C→F”的离子方程式:_______________________。
(3)写出反应“F→G”的化学方程式:_______________。
(4)在溶液I中滴入NaOH溶液,可观察到的现象是__________________。
【答案】Al H2 Fe(OH)3 Al3++3NH3·H2O=Al(OH)3↓+3NH4+ Al(OH)3+ NaOH=NaAlO2+2H2O 先生成白色絮状沉淀,而后迅速变为灰绿色,最后变为红褐色沉淀
【解析】
K为红褐色沉淀,则应为Fe(OH)3,则溶液J中含有Fe3+,所以H为Fe,D应为H2,E应为Cl2,B为HCl,则I为FeCl2,J为FeCl3,K为Fe(OH)3,白色沉淀F能溶于过量NaOH溶液,则F为Al(OH)3,G为NaAlO2,A为Al,C为AlCl3。据此解答。
(1)根据以上分析可知A是Al,D是H2,K是Fe(OH)3;
(2)反应“C→F”的离子方程式:Al3++3NH3·H2O=Al(OH)3↓+3NH4+;
(3)反应“F→G”的化学方程式:Al(OH)3+NaOH=NaAlO2+2H2O;
(4)FeCl2中滴入NaOH溶液发生反应:FeCl2+2NaOH=Fe(OH)2↓+2NaCl、4Fe(OH)2+O2+4H2O=4Fe(OH)3。因此实验现象是先生成白色絮状沉淀,而后迅速变为灰绿色,最后变为红褐色沉淀。

 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案【题目】合成氨工业对国民经济和社会发展具有重要的意义。 合成塔中发生反应为: N2(g)+3H2(g)![]() 2NH3(g) △H<0
2NH3(g) △H<0
(1)工业生产时,制取氢气的一个反应为:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H>0
CO2(g)+H2(g) △H>0
①t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。
该温度下此反应的平衡常数K =__________________________。
②保持温度不变,向上述平衡体系中再加入0.1mol CO,当反应重新建立平衡时,水蒸气的总转化率α (H2O)__________。
(2)下表为不同温度下合成氨反应的平衡常数。由表可推知T1_____573K(填“>”、“<”或“=”)。
T/K | T1 | 573 | T2 |
K | 1.00×107 | 2.45×105 | 1.88×103 |
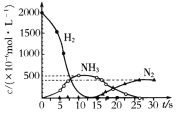
(3)673K,30MPa下n(NH3) 和n(H2) 随时间变化的关系如下图所示依据上图,下列有关叙述正确的是(填写序号)_________________。

A.c点表示n(NH3)和n (H2)相等
B.c点表示NH3生成速率与NH3分解速率相同
C.e点和d点时反应的平衡常数相同
D.c点时正反应速率大于逆反应速率
(4)用NO2溶于水制硝酸:3NO2+H2O![]() 2HNO3+NO。从生产流程看,吸收塔中需
2HNO3+NO。从生产流程看,吸收塔中需
要补充空气,其原因用化学平衡移动的理论进行解释是______________。
(5)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气。目前科学家探索
利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g); △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g); △H=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:_______________________。