题目内容
取一根镁条置于坩埚内点燃,得到氧化镁和氮化镁的混合物的总质量为0.470 g,冷却后加入足量水,再将溶液蒸干并灼烧得到氧化镁0.486 g,按要求完成下列问题:
(1)氮化镁的电子式____________________________。
(2)混合物中加入水的反应方程式____________________________。
(3)燃烧产物中氧化镁的质量分数____________________________。
(4)镁燃烧生成氧化镁和氮化镁时,共转移电子____________________________mol。
(1)氮化镁的电子式____________________________。
(2)混合物中加入水的反应方程式____________________________。
(3)燃烧产物中氧化镁的质量分数____________________________。
(4)镁燃烧生成氧化镁和氮化镁时,共转移电子____________________________mol。
(1)Mg2+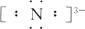 Mg2+
Mg2+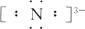 Mg2+
Mg2+
(2)Mg3N2+6H2O====3Mg(OH)2↓+2NH3↑,MgO+H2O====Mg(OH)2
(3)83%
(4)2.43×10-2
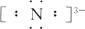 Mg2+
Mg2+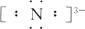 Mg2+
Mg2+(2)Mg3N2+6H2O====3Mg(OH)2↓+2NH3↑,MgO+H2O====Mg(OH)2
(3)83%
(4)2.43×10-2
镁无论和氧气反应,还是和氮气反应,1 mol镁均失电子2 mol,故镁转移电子数为: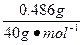 ×2=2.43×10-2 mol
×2=2.43×10-2 mol
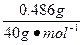 ×2=2.43×10-2 mol
×2=2.43×10-2 mol
练习册系列答案
相关题目
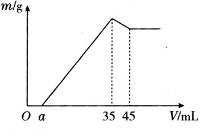
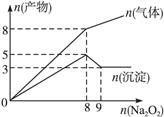
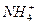 的混合液中并微热,产生沉淀和气体的物质的量(mol)与加入Na2O2的物质的量(mol)的关系如图所示,则原溶液中Al3+、Mg2+、
的混合液中并微热,产生沉淀和气体的物质的量(mol)与加入Na2O2的物质的量(mol)的关系如图所示,则原溶液中Al3+、Mg2+、