题目内容
准确称取6 g铝土矿样品(含Al2O3、Fe2O3、SiO2)放入盛有100 mL某浓度硫酸溶液的烧杯中,充分反应后过滤,向滤液中加入10 mol·L-1的NaOH溶液,产生的沉淀质量m与加入的NaOH溶液的体积V的关系如图所示:
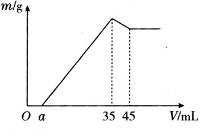
请填空回答:(1)H2SO4溶液的物质的量浓度为_________________。
(2)若a=2.3,用于沉淀Fe3+消耗NaOH的体积是____________mL,铝土矿中各组成分的质量分数:Al2O3为______________,Fe2O3为______________,SiO2为______________。
(3)a值的范围应是______________,在这个范围内,a值越大______________的质量分数越小。

请填空回答:(1)H2SO4溶液的物质的量浓度为_________________。
(2)若a=2.3,用于沉淀Fe3+消耗NaOH的体积是____________mL,铝土矿中各组成分的质量分数:Al2O3为______________,Fe2O3为______________,SiO2为______________。
(3)a值的范围应是______________,在这个范围内,a值越大______________的质量分数越小。
(1)1.75 mol·L-1
(2)2.7 85% 12% 3%
(3)1.625<a<5 Fe2O3
(2)2.7 85% 12% 3%
(3)1.625<a<5 Fe2O3
(1)从图中可知,当加入35 mL NaOH溶液时沉淀质量达到最大值,此过程可表示为:
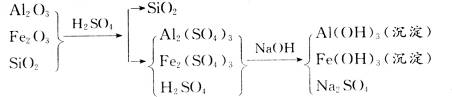
由图示关系知,当最后溶液中溶质中有Na2SO4时,沉淀的质量最大,此时n(NaOH)="10" mol·L-1×0.035 L="0.35" mol,由此建立加入H2SO4和NaOH的物质的量的关系:
H2SO4—Na2SO4—2NaOH
1 2
0.175 mol0.35 mol
故c(H2SO4)="0.175" mol/0.1 L="1.75" mol·L-1。
(2)为了方便解答问题(3),在计算有关成分的质量分数时,保留a至最后。由图可知,溶解Al(OH)3消耗NaOH为10 mol·L-1×(45-35)×10-3 L="0.1" mol。
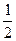 Al2O3— Al3+— Al(OH)3— OH-
Al2O3— Al3+— Al(OH)3— OH-
0.05 mol 0.1 mol 0.1 mol 0.1 mol
Al2O3的质量分数为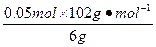 ×100%=85%
×100%=85%
沉淀Al3+耗NaOH 0.3 mol,沉淀Al3+和Fe3+共耗NaOH 10 mol·L-1×(35-a)×10-3 L,故沉淀Fe3+耗NaOH:10 mol·L-1×(35-a)×10-3 L-0.3 mol=(0.05-0.01a)mol
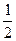 Fe2O3 — Fe3+? — 3OH-
Fe2O3 — Fe3+? — 3OH-
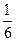 (0.05-0.01a)mol (0.05-0.01a)mol
(0.05-0.01a)mol (0.05-0.01a)mol
Fe2O3的质量分数为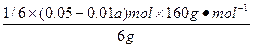 ×100%=
×100%=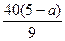 %
%
SiO2的质量分数为1-85%-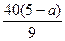 %=
%=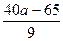 %
%
最后把a=2.3代入上述有关代数式,得沉淀Fe3+消耗NaOH的体积:
V(NaOH)=(0.05-0.01a)mol/10 mol·L-1=(0.05-0.01×2.3)mol/10 mol·L-1=2.7×10-3L="2.7" mL。故Fe2O3的质量分数为12%;SiO2的质量分数为3%。
(3)因为Al2O3的质量分数与a值无关,即为85%,则Fe2O3质量分数必然满足下列不等式:0<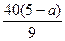 %<15%,解此不等式得:1.625<a<5,结合w(Fe2O3)和w(SiO2)知,a值越大,w(Fe2O3)越小,w(SiO2)越大。
%<15%,解此不等式得:1.625<a<5,结合w(Fe2O3)和w(SiO2)知,a值越大,w(Fe2O3)越小,w(SiO2)越大。
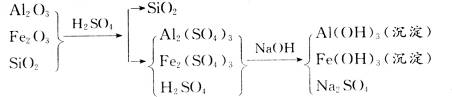
由图示关系知,当最后溶液中溶质中有Na2SO4时,沉淀的质量最大,此时n(NaOH)="10" mol·L-1×0.035 L="0.35" mol,由此建立加入H2SO4和NaOH的物质的量的关系:
H2SO4—Na2SO4—2NaOH
1 2
0.175 mol0.35 mol
故c(H2SO4)="0.175" mol/0.1 L="1.75" mol·L-1。
(2)为了方便解答问题(3),在计算有关成分的质量分数时,保留a至最后。由图可知,溶解Al(OH)3消耗NaOH为10 mol·L-1×(45-35)×10-3 L="0.1" mol。
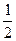 Al2O3— Al3+— Al(OH)3— OH-
Al2O3— Al3+— Al(OH)3— OH-0.05 mol 0.1 mol 0.1 mol 0.1 mol
Al2O3的质量分数为
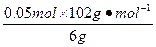 ×100%=85%
×100%=85%沉淀Al3+耗NaOH 0.3 mol,沉淀Al3+和Fe3+共耗NaOH 10 mol·L-1×(35-a)×10-3 L,故沉淀Fe3+耗NaOH:10 mol·L-1×(35-a)×10-3 L-0.3 mol=(0.05-0.01a)mol
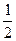 Fe2O3 — Fe3+? — 3OH-
Fe2O3 — Fe3+? — 3OH-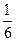 (0.05-0.01a)mol (0.05-0.01a)mol
(0.05-0.01a)mol (0.05-0.01a)molFe2O3的质量分数为
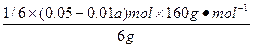 ×100%=
×100%=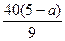 %
%SiO2的质量分数为1-85%-
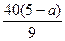 %=
%=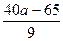 %
%最后把a=2.3代入上述有关代数式,得沉淀Fe3+消耗NaOH的体积:
V(NaOH)=(0.05-0.01a)mol/10 mol·L-1=(0.05-0.01×2.3)mol/10 mol·L-1=2.7×10-3L="2.7" mL。故Fe2O3的质量分数为12%;SiO2的质量分数为3%。
(3)因为Al2O3的质量分数与a值无关,即为85%,则Fe2O3质量分数必然满足下列不等式:0<
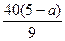 %<15%,解此不等式得:1.625<a<5,结合w(Fe2O3)和w(SiO2)知,a值越大,w(Fe2O3)越小,w(SiO2)越大。
%<15%,解此不等式得:1.625<a<5,结合w(Fe2O3)和w(SiO2)知,a值越大,w(Fe2O3)越小,w(SiO2)越大。
练习册系列答案
相关题目