题目内容
沼气是一种能源,它的主要成分是CH4。0.5molCH4完全燃烧生成CO2和液态水时放出445kJ的热量,则下列热化学方程式中正确的是
| A.2CH4(g) + 4O2(g) =2CO2(g) + 4H2O(l) ΔH=+890kJ·mol-1 |
| B.CH4(g) + 2O2(g) =CO2(g) + 2H2O(l) ΔH=+890kJ·mol-1 |
| C.CH4(g) + 2O2(g) =CO2(g) + 2H2O(l) ΔH=-890kJ·mol-1 |
| D.1/2CH4(g) + O2(g) =1/2CO2(g) + H2O(l) ΔH=-890kJ·mol-1 |
C
试题分析:根据热化学方程式的书写方法可知,化学计量数与反应热成正比,并注意标明物质的聚集状态来解答。0.5mol CH4完全燃烧生成CO2和液态水时,放出445KJ热量,则1molCH4在氧气中燃烧生成CO2和液态水,放出890kJ热量,△H为负值,则热化学方程式为CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890kJ/mol,故选C。

练习册系列答案
相关题目
 2NO(g) △H=+180.5kJ·mol-1
2NO(g) △H=+180.5kJ·mol-1 

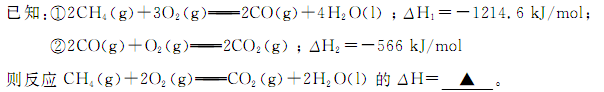
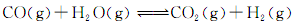 ,得到如下三组数据:
,得到如下三组数据: