题目内容
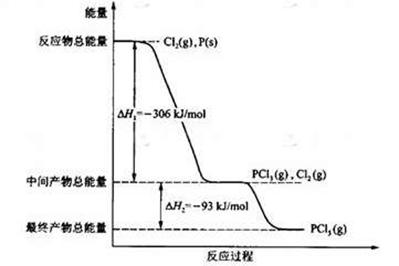
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示( 图中的△H表示生成1mol产物的数据)。根据图示,回答下列问题:

⑴P和Cl2反应生成PCl3(g)的热化学方程式 。
⑵PCl5(g)分解成PCl3(g)和Cl2的热化学方程式 。
⑶白磷能自燃,红磷不能自燃。白磷转变成红磷为 (“放”或“吸”) 热反应。如果用白磷替代红磷和Cl2反应生成1molPCl5的△H3,则△H3 △H1 (填“<”、“>” 或 “=”)。

⑴P和Cl2反应生成PCl3(g)的热化学方程式 。
⑵PCl5(g)分解成PCl3(g)和Cl2的热化学方程式 。
⑶白磷能自燃,红磷不能自燃。白磷转变成红磷为 (“放”或“吸”) 热反应。如果用白磷替代红磷和Cl2反应生成1molPCl5的△H3,则△H3 △H1 (填“<”、“>” 或 “=”)。
(1)P(s)+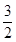 Cl2(g)=PCl3(g)△H="-306" kJ/mol
Cl2(g)=PCl3(g)△H="-306" kJ/mol
(2)PCl5(g)=PCl3(g)+Cl2(g)△H="+93" kJ/mol (3)放;<
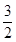 Cl2(g)=PCl3(g)△H="-306" kJ/mol
Cl2(g)=PCl3(g)△H="-306" kJ/mol(2)PCl5(g)=PCl3(g)+Cl2(g)△H="+93" kJ/mol (3)放;<
试题分析:(1)根据图示可知:P(s)+
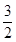 Cl2(g)=PCl3(g),反应物的总能量大于生成物的总能量,该反应是放热反应,反应热为△H=-306 kJ/mol,则热化学方程式为:P(s)+
Cl2(g)=PCl3(g),反应物的总能量大于生成物的总能量,该反应是放热反应,反应热为△H=-306 kJ/mol,则热化学方程式为:P(s)+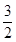 Cl2(g)=PCl3(g)△H="-306" kJ/mol。
Cl2(g)=PCl3(g)△H="-306" kJ/mol。(2)根据图示可知:Cl2(g)+PCl3(g)=PCl5(g),中间产物的总能量大于最终产物的总能量,该反应是放热反应,△H=生成物总能量-反应物总能量=-93 kJ/mol;所以PCl5(g)=PCl3(g)+Cl2(g)是吸热反应;热化学方程式:PCl5(g)=PCl3(g)+Cl2(g)△H="+93" kJ/mol。
(3)白磷能自燃,红磷不能自燃,这说明白磷的总能量高于红磷的总能量,因此白磷转变成红磷为放热反应。由于白磷总能量高于红磷总能量,所以如果用白磷替代红磷和Cl2反应生成1molPCl5时放出的热量多,则反应热△H3<△H1。

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
 1等于 ;若反应温度由T1升高到T2,平衡时PCl5的分解率为
1等于 ;若反应温度由T1升高到T2,平衡时PCl5的分解率为
