题目内容
(Ⅰ)碳和碳的化合物在人类生产、生活中的应用非常广泛。“低碳生活”不再只是一种理想,更是一种值得期待的生活方式。
(1)甲烷燃烧时放出大量的热,可作为能源应用于人类的生产和生活。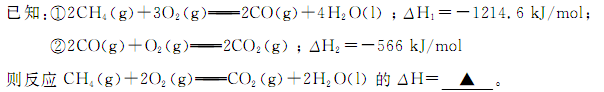
(2)将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。其负极电极反应式是: 。
(3)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应:
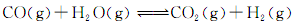 ,得到如下三组数据:
,得到如下三组数据:
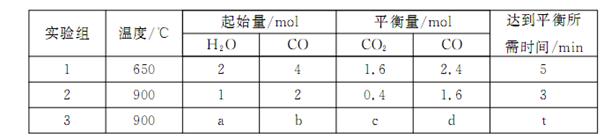
①实验1中,以v( H2)表示的平均反应速率为: 。
②该反应的正反应为 (填“吸”或“放”)热反应;
③若要实验3达到与实验2相同的平衡状态(即各物质的体积分数分别相等),则a、b应满足的关系是 (用含a、b的数学式表示)。
(Ⅱ)某小组运用工业上离子交换膜法制烧碱的原理,用如下图所示装置电解K2SO4溶液。
①该电解槽中通过阴离子交换膜的离子数 (填“>”“<”或“一”)通过阳离子交换膜的离子数;
②图中a、b、c、d分别表示有关溶液的pH,则a、b、c、d由小到大的顺序为 ;
③电解一段时间后,B出口与C出口产生气体的质量比为 。
(1)甲烷燃烧时放出大量的热,可作为能源应用于人类的生产和生活。
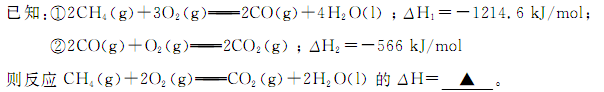
(2)将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。其负极电极反应式是: 。
(3)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应:
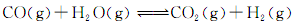 ,得到如下三组数据:
,得到如下三组数据:
①实验1中,以v( H2)表示的平均反应速率为: 。
②该反应的正反应为 (填“吸”或“放”)热反应;
③若要实验3达到与实验2相同的平衡状态(即各物质的体积分数分别相等),则a、b应满足的关系是 (用含a、b的数学式表示)。
(Ⅱ)某小组运用工业上离子交换膜法制烧碱的原理,用如下图所示装置电解K2SO4溶液。

①该电解槽中通过阴离子交换膜的离子数 (填“>”“<”或“一”)通过阳离子交换膜的离子数;
②图中a、b、c、d分别表示有关溶液的pH,则a、b、c、d由小到大的顺序为 ;
③电解一段时间后,B出口与C出口产生气体的质量比为 。
(Ⅰ)(1) -890.3 kJ/mol (2分)
(2) CH4 -8e-+10OH - ==CO3 2- +7H2O (2分)
(3) ①0.16 mol·L-1·min-1 (2分) ②放 (1分)
③a∶b=1∶2(或b=2a) (2分)
(Ⅱ)① < (1分)
② b<a<c<d (2分)。 ③ 8∶1 (2分)
(2) CH4 -8e-+10OH - ==CO3 2- +7H2O (2分)
(3) ①0.16 mol·L-1·min-1 (2分) ②放 (1分)
③a∶b=1∶2(或b=2a) (2分)
(Ⅱ)① < (1分)
② b<a<c<d (2分)。 ③ 8∶1 (2分)
试题分析:(1)将两个方程式相加再除以2即得所求的反应,故所求反应的ΔH=(ΔH1+ΔH2)/2,带入数值可得ΔH=-890.3 kJ/mol;(2)原电池中负极发生氧化反应,故通入甲烷的一极为负极,甲烷失去电子,在碱性条件下生成碳酸根离子;(3)①根据表格中的CO的起始量和平衡量可得转化量为1.6mol,生成氢气的物质的量为1.6mol,浓度变化量为0.8mol/L,再除以时间5分钟可得0.16 mol·L-1·min-1②温度升高,CO的转化率减小,说明升高温度平衡向左移动,故正反应为放热反应;③若要实验3达到与实验2相同的平衡状态,则只要划归为原比即可,水和一氧化碳的起始值满足1:2,即a:b=1:2;(Ⅱ)①左边消耗2个氢氧根离子需要移动一个硫酸根离子来满足左边溶液的电荷守恒,右边消耗2个氢离子就需要移动2个钾离子来满足溶液电荷守恒,故通过阴离子交换膜的离子数小于通过阳离子交换膜的离子数;②左边接电源的正极,是阳极,在阳极上OH-放电生成氢离子,使pH减小,右边是阴极,在阴极上,氢离子放电生成氢氧根离子使pH增大,故b<a<c<d③根据两极上转移电子数目相等,在阳极上生成的氧气和阴极上生成的氢气的物质的量之比为1:2,质量比为8:1。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目


 2NH3。已知,在常温下,1 g H2完全转化为NH3,放出的热量为15.4 kJ。
2NH3。已知,在常温下,1 g H2完全转化为NH3,放出的热量为15.4 kJ。