题目内容
【题目】某温度时,在一个2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
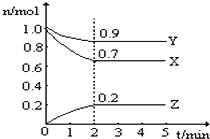
(1)该反应的化学方程式为_______________________
(2)从开始至2min,Z的平均反应速率为___________
(3)其他条件不变,升高温度,逆反应速率将________(填“加快”、“减慢”或“不变”)。
(4)某探究性学习小组用相同质量的锌和相同浓度的足量的稀盐酸反应得到实验数据如下表所示:
实验编号 | 锌的状态 | 反应温度/℃ | 收集100mL氢气所需时间/S |
Ⅰ | 薄片 | 15 | 200 |
Ⅱ | 薄片 | 25 | 90 |
Ⅲ | 粉末 | 25 | 10 |
①该实验的目的是探究 ______ 、 ______ 对锌和稀盐酸反应速率的影响;
②实验Ⅰ和Ⅱ表明 ______ ,化学反应速率越大;
③能表明固体的表面积对反应速率有影响的实验编号是 ______ 和 ______ ;
【答案】3X(g)+Y(g)2Z(g) 0.05mol/(L·min) 加快 接触面积 温度 其他条件相同时,温度越高 II III
【解析】
由图可知,Y、X的物质的量减小,Z的物质的量增加,则Y、X为反应物,Z为生成物,Y、X、Z的△n之比为(1-0.9):(1-0.7):(0.2-0)=1:3:2,2min达到平衡状态,由反应速率之比等于化学计量数之比可知,反应为3X(g)+Y(g)2Z(g),结合v=![]() /
/![]() ;转化率=变化量/开始量
;转化率=变化量/开始量![]() 及反应速率影响因素来解答。
及反应速率影响因素来解答。
(1)由图可Y、X的物质的量减小,Z的物质的量增加,则Y、X为反应物,Z为生成物,Y、X、Z的△n之比为(10.9):(10.7):(0.20)=1:3:2,2min达到平衡状态,由反应速率之比等于化学计量数之比可知,反应为3X(g)+Y(g)2Z(g);答案:3X(g)+Y(g)2Z(g)。
(2)从开始至2min,Z的平均反应速率为0.2mol/(2L![]() 2min)=0.05molL1min1,故答案为:0.05mol/(L·min);
2min)=0.05molL1min1,故答案为:0.05mol/(L·min);
(3)根据影响化学反应速率的因素可知:其他条件不变,升高温度,正、逆反应速率都加快;答案:加快。
(4)①由表格中的数据可以知道,锌的状态不同、温度不同,则实验目的为探究接触面积、温度对锌和稀盐酸反应速率的影响,本题正确答案是:接触面积;温度;
②实验Ⅰ和Ⅱ中,温度不同, 其他条件相同,温度大的反应速率快,即温度越高,反应速率越快;本题正确答案是: 其他条件相同时,温度越高;
③能表明固体的表面积对反应速率有影响,应控制温度相同,则应为II和III组实验;本题正确答案是: II;III。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】已知部分弱酸的电离平衡常数如下表所示:
弱酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
电离平衡常数Ka(25℃) | 1.75×10-5 | 2.98×10-8 | Ka1=4.3×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-7 Ka2=1.02×10-7 |
下列离子方程式正确的是
A. 少量的CO2通入NaClO溶液中:CO2+H2O+2C1O-==CO32-+2HClO
B. 少量的SO2通入Na2CO3溶液中:SO2+H2O+2CO32-==SO32-+2HCO3-
C. 少量的SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-==CaSO3↓+2HClO
D. 相同浓度的NaHCO3溶液与NaHSO3溶液等体积混合:H++HCO3-==CO2↑+H2O