题目内容
【题目】我国是世界稀土资源大国,稀土元素是镧系、钪![]() 、钇
、钇![]() 种元素的总称,它们位于元索周期表中同一副族。
种元素的总称,它们位于元索周期表中同一副族。
![]() 原子的价层电子排布式为______,第一电离能Sc______Y
原子的价层电子排布式为______,第一电离能Sc______Y![]() 填“大于”或“小于”
填“大于”或“小于”![]() 。
。
![]() 是生产铈的中间化合物,它可由氟碳酸铈
是生产铈的中间化合物,它可由氟碳酸铈![]()
![]() 精矿制得:
精矿制得:
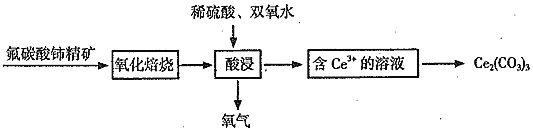
![]() 中,Ce的化合价为______。
中,Ce的化合价为______。
![]() 氧化焙烧生成二氧化铈
氧化焙烧生成二氧化铈![]() ,其在酸浸时发生反应的离子方程式为______。
,其在酸浸时发生反应的离子方程式为______。
![]() 离子的立体构型的名称为______,中心原子的杂化方式为______,分子或离子中的大
离子的立体构型的名称为______,中心原子的杂化方式为______,分子或离子中的大![]() 键可用符号
键可用符号![]() 表示,其中m代表参与形成大
表示,其中m代表参与形成大![]() 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大![]() 键的电子数
键的电子数![]() 如苯分子中的大
如苯分子中的大![]() 键可表示为
键可表示为![]() ,则
,则![]() 中的大
中的大![]() 键应表示为______。
键应表示为______。
![]() 常温、常压下
常温、常压下![]() 是铈最稳定的化合物,广泛用于玻璃、原子能、电子管等工业。
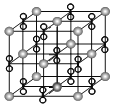
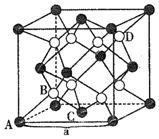
是铈最稳定的化合物,广泛用于玻璃、原子能、电子管等工业。![]() 晶胞是立方萤石型,则铈离子的配位数为______,如图中离子坐标参数
晶胞是立方萤石型,则铈离子的配位数为______,如图中离子坐标参数![]() 0,
0,![]() ;
;![]() :
:![]() ,若将B选为晶胞顶点坐标参数
,若将B选为晶胞顶点坐标参数![]() 0,
0,![]() ,则D离子处于______位置,坐标参数为______。已知该晶胞的棱长
,则D离子处于______位置,坐标参数为______。已知该晶胞的棱长![]() ,其密度为______
,其密度为______![]() 列出计算式即可
列出计算式即可![]() 。
。
【答案】![]() 大于
大于 ![]()
![]() 平面三角形
平面三角形 ![]()
![]() 8 体心
8 体心 ![]()
![]()
【解析】
(1)Sc位于周期表中第4周期第ⅢA族,则其价电子排布式为![]() ,V位于周期表中第4周期第ⅤA族,则其价电子排布式为
,V位于周期表中第4周期第ⅤA族,则其价电子排布式为![]() ,Sc与Y同族,第一电离能Sc大于Y;
,Sc与Y同族,第一电离能Sc大于Y;
(2)①根据CeFCO3呈电中性,F为![]() 价,CO32-为
价,CO32-为![]() 价,则Ce为
价,则Ce为![]() 价;
价;
②氧化焙烧生成二氧化铈(CeO2),酸浸时,加入稀硫酸和H2O2,Ce(Ⅳ),Ce(Ⅳ)转化为,Ce(Ⅲ),H2O2被氧化生成O2;
③对于CO32-,根据VSEPR理论,价电子对数为![]() ,根据杂化轨道理论,中心C原子的杂化方式为
,根据杂化轨道理论,中心C原子的杂化方式为![]() ,其空间构型为平面三角形,CO32-中,C为
,其空间构型为平面三角形,CO32-中,C为![]() 杂化,形成3根共价键,一个s电子跃迁到
杂化,形成3根共价键,一个s电子跃迁到![]() 轨道,每个O还留有一个
轨道,每个O还留有一个![]() 轨道上的一个单电子,整个CO32-形成4中心6电子的离域大
轨道上的一个单电子,整个CO32-形成4中心6电子的离域大![]() 键,所以记为
键,所以记为![]() ;
;
(3)根据晶胞结构分析,O2-做四面体填隙,Ce4+做面心立方最密堆积,从上底面面心的Ce4+看,Ce4+连接两个晶胞,一个晶胞内与之等距且最近的![]() 数目为4,所以铈离子的配位数为8,如图中离子坐标参数A(0,0,0);
数目为4,所以铈离子的配位数为8,如图中离子坐标参数A(0,0,0);![]() :
:![]() ,C处于底心,B处于
,C处于底心,B处于![]() 处,若将B选为晶胞顶点坐标参数B (0,0,0),相当于对A进行(0,0,0)
处,若将B选为晶胞顶点坐标参数B (0,0,0),相当于对A进行(0,0,0)![]() ,
,![]() ,
,![]() ,则D的坐标应变为
,则D的坐标应变为![]() ,则D变为体心,坐标参数为
,则D变为体心,坐标参数为![]() ;一个晶胞中含有Ce4+数目为
;一个晶胞中含有Ce4+数目为![]() 个,含有O2-的数目为8个,则1mol晶胞的质量为
个,含有O2-的数目为8个,则1mol晶胞的质量为![]() ,1个晶胞的体积为
,1个晶胞的体积为![]() ,则晶体密度为
,则晶体密度为![]() 。
。
(1)Sc位于周期表中第4周期第ⅢA族,则其价电子排布式为![]() ,V位于周期表中第4周期第ⅤA族,则其价电子排布式为
,V位于周期表中第4周期第ⅤA族,则其价电子排布式为![]() ,Sc与Y同族,第一电离能Sc大于Y,
,Sc与Y同族,第一电离能Sc大于Y,
故答案为:![]() ;大于;
;大于;
(2)①根据CeFCO3呈电中性,F为![]() 价,CO32-为
价,CO32-为![]() 价,则Ce为
价,则Ce为![]() 价,
价,
故答案为:![]() ;
;
②氧化焙烧生成二氧化铈(CeO2),酸浸时,加入稀硫酸和H2O2,Ce(Ⅳ),Ce(Ⅳ)转化为,Ce(Ⅲ),H2O2被氧化生成O2,所以发生的化学反应为:![]() ,
,
故答案为:![]() ;
;
③对于CO32-,根据VSEPR理论,价电子对数为![]() ,根据杂化轨道理论,中心C原子的杂化方式为
,根据杂化轨道理论,中心C原子的杂化方式为![]() ,其空间构型为平面三角形,CO32-中,C为
,其空间构型为平面三角形,CO32-中,C为![]() 杂化,形成3根共价键,一个s电子跃迁到
杂化,形成3根共价键,一个s电子跃迁到![]() 轨道,每个O还留有一个
轨道,每个O还留有一个![]() 轨道上的一个单电子,整个CO32-形成4中心6电子的离域大
轨道上的一个单电子,整个CO32-形成4中心6电子的离域大![]() 键,所以记为
键,所以记为![]() ,
,
故答案为:![]() ;
;
(3)根据晶胞结构分析,O2-做四面体填隙,Ce4+做面心立方最密堆积,从上底面面心的Ce4+看,Ce4+连接两个晶胞,一个晶胞内与之等距且最近的![]() 数目为4,所以铈离子的配位数为8,如图中离子坐标参数A(0,0,0);
数目为4,所以铈离子的配位数为8,如图中离子坐标参数A(0,0,0);![]() :
:![]() ,C处于底心,B处于
,C处于底心,B处于![]() 处,若将B选为晶胞顶点坐标参数B (0,0,0),相当于对A进行(0,0,0)
处,若将B选为晶胞顶点坐标参数B (0,0,0),相当于对A进行(0,0,0)![]() ,
,![]() ,
,![]() ,则D的坐标应变为
,则D的坐标应变为![]() ,则D变为体心,坐标参数为
,则D变为体心,坐标参数为![]() ;该晶胞的棱长
;该晶胞的棱长![]() ,取1mol这样的晶胞,一个晶胞中含有Ce4+数目为
,取1mol这样的晶胞,一个晶胞中含有Ce4+数目为![]() 个,含有O2-的数目为8个,则1mol晶胞的质量为
个,含有O2-的数目为8个,则1mol晶胞的质量为![]() ,1个晶胞的体积为
,1个晶胞的体积为![]() ,则晶体密度为
,则晶体密度为![]() ,
,
故答案为:8;体心;![]() ;
;![]() 。
。

【题目】研究NO2、NO、SO2、CO等大气污染气体的处理具有重要意义。利用反应6NO2(g)+8NH3(g)![]() 7N2(g)+12H2O(g)可处理NO2。
7N2(g)+12H2O(g)可处理NO2。
(1)在2L的密闭容器中,2分钟内,上述反应混合物的物质的量增加了0.25mol,则2分钟内v(NH3)=______。
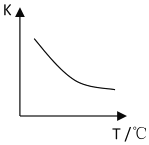
(2)该反应的化学平衡常数表达式K=______;已知该反应平衡常数(K)与温度(T)的关系如图所示,若升高温度,则v正反应______v逆反应(填“大于”、“小于”或“等于”);反应达到平衡后若缩小反应容器体积,其它条件不变,则混合气体的平均式量将______(填“变大”、“变小”或“不变”)。
酸雨是大气污染的危害之一,二氧化硫(SO2)的含量是空气质量监测的一个重要指标。某兴趣小组同学收集某地的雨水进行实验,每隔1h,通过pH计测定雨水样品的pH,测得的结果如下表:
测定时间/h | 0 | 1 | 2 | 3 | 4 |
雨水样品的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
(3)请写出上述pH变化的原因______。
(4)有物质的量浓度相等的三种铵盐溶液:①NH4Cl ②NH4HCO3 ③NH4HSO4,这三种溶液中水的电离程度由大到小的顺序是______(填编号)。
(5)向BaCl2溶液中通入足量SO2气体,没有沉淀生成,继续滴加一定量的氨水后,生成BaSO3沉淀,用电离平衡原理解释上述现象。______。
【题目】根据下列实验现象所得出的结论正确的是
选项 | 实验现象 | 实验结论 |
A | 将铝片分别投入浓、稀硝酸中,前者无明显现象,后者反应剧烈 | 稀硝酸的氧化性比浓硝酸的强 |
B | 滴有酚酞的Na2CO3溶液中加入BaCl2溶液,红色变浅 | Na2CO3溶液中存在水解平衡 |
C | 某溶液中滴加过量氨水产生白色沉淀且不溶解 | 该溶液中一定含有Mg2+ |
D | 溴水中通入SO2,溴水褪色 | SO2具有漂白性 |
A. A B. B C. C D. D
【题目】一定条件下对于可逆反应![]() ,若X、Y、Z三种气体的初始浓度和平衡浓度如下表(c1、c2、c3均不为零):
,若X、Y、Z三种气体的初始浓度和平衡浓度如下表(c1、c2、c3均不为零):
物质 | X | Y | Z |
初始浓度(mol·L-1) | c1 | c2 | c3 |
平衡浓度(mol·L-1) | 0.2 | 0.3 | 0.12 |
则下列判断正确的是( )
A.c1∶c2=2∶3
B.平衡时Y和Z的生成速率之比为2∶3
C.X、Y的转化率之比为2:3
D.c1的取值范围为0<c1<0.3