题目内容
【题目】已知:25 C 时,Ksp[Zn(OH)2]= 1.0×10-18, Ka(HCOOH)= 1.0×10-4。该温度下,下列说法错误的是
A. HCOO-的水解平衡常数为 1.0×10-10
B. 向 Zn(OH)2 悬浊液中加少量 HCOOH,溶液中 c(Zn2+)增大
C. Zn(OH)2溶于水形成的饱和溶液中,c(Zn2+)>1.0×10-6 mol/L
D. Zn(OH)2(s) +2HCOOH(aq)![]() Zn2+(aq) +2HCOO-(aq) +2H2O(l)的平衡常数 K= 100
Zn2+(aq) +2HCOO-(aq) +2H2O(l)的平衡常数 K= 100
【答案】C
【解析】A、根据弱酸的电离平衡常数和水解平衡常数的关系,即Kw=Ka×Kh,所以HCOO-的水解平衡常数为Kh=Kw/Ka=1.0×10-10,所以A正确;B、随着酸碱中和反应的进行,Zn(OH)2 悬浊液逐渐溶液,使溶液中c(Zn2+)增大,故B正确;C、Zn(OH)2溶于水形成的饱和溶液中,c(Zn2+)= ![]() <1.0×10-6 mol/L,所以C错误;D、根据化学反应方程式可得,平衡常数K=
<1.0×10-6 mol/L,所以C错误;D、根据化学反应方程式可得,平衡常数K= 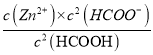 =
= 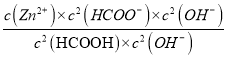 =
= ![]() = 100,所以D正确。本题正确答案为C。
= 100,所以D正确。本题正确答案为C。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目