题目内容
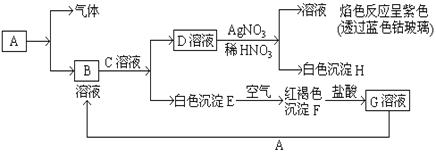
【题目】某化学小组通过灼烧法测定CuxSy的组成,并验证气体产物SO2的部分性质,设计实验如下(夹持装置略去):
I.测定CuxSy的组成

步骤一:用上图所示装置高温灼烧16.0gCuxSy至固体质量不再变化,停止加热,继续通入O2至硬质玻璃管冷却。
步骤二:向装置D所得溶液中加入足量双氧水,再加入过量BaCl2溶液;将生成的沉淀过滤、洗涤、干燥、称量得沉淀质量为23.3 g。
(1)装置C中用于加热的仪器名称为___________________。
(2)步骤一中,停止加热后,继续通入O2的主要作用为___________________。
(3)由实验数据推断得CuxSy的化学式为___________________。
(4)若无装置E,则所测x∶y的值 ________(填“偏大”“ 偏小”或“无影响”)。.
Ⅱ.该小组选用实验I中的装置A、B、C和下图所示装置,依次验证SO2的漂白性,氧化性和还原性。

(5)按气流方向,装置的合理连接顺序为A→B→C→______________(填装置字母)。
(6)试剂X的名称为_____________。能证明SO2有还原性的实验现象为______________。
(7)装置G中发生反应的离子方程式为________________________。
【答案】 酒精喷灯 使生成的SO2全部被装置D中的NaOH溶液吸收,减小误差。 Cu2S 偏小 I→G→H→J 品红溶液 装置H中酸性KMnO4溶液褪色或变浅 2S2-+2H2O+5SO2=3S↓+4HSO3-
【解析】I.(1)根据装置图,装置C中用于加热的仪器是酒精喷灯,故答案为:酒精喷灯;
(2)步骤一中,停止加热后,继续通入O2可以使生成的SO2全部被装置D中的NaOH溶液吸收,减小误差,故答案为:使生成的SO2全部被装置D中的NaOH溶液吸收,减小误差;
(3)向装置D所得溶液中加入足量双氧水,再加入过量BaCl2溶液;将生成的沉淀过滤、洗涤、干燥、称量得沉淀质量为23. 3 g,沉淀为硫酸钡,物质的量为![]() =0.1mol,说明原固体中含有0.1molS,质量为0.1mol×32g/mol=3.2g,则Cu元素的质量为16.0g-3.2g=12.8g,物质的量为
=0.1mol,说明原固体中含有0.1molS,质量为0.1mol×32g/mol=3.2g,则Cu元素的质量为16.0g-3.2g=12.8g,物质的量为![]() =0.2mol,Cu与S元素的物质的量之比为2:1,则CuxSy的化学式为Cu2S ,故答案为:Cu2S ;
=0.2mol,Cu与S元素的物质的量之比为2:1,则CuxSy的化学式为Cu2S ,故答案为:Cu2S ;
(4)装置E可以防止空气中的二氧化碳进入D,若无装置E,则D的质量增加量偏大,S的含量偏大,则所测x∶y的值偏小,故答案为:偏小;
Ⅱ.(5)SO2可使品红溶液的红色褪去,体现二氧化硫的漂白性;SO2与H2S能发生SO2+2H2S=3S+2H2O体现二氧化硫的氧化性;二氧化硫能够使高锰酸钾有强氧化性,二氧化硫和高锰酸钾能发生5SO2+2MnO4+2H2O═5SO42-+2Mn2++4H+紫色褪去,体现二氧化硫的还原性。要依次验证SO2的漂白性,氧化性和还原性,按气流方向,装置的合理连接顺序为A→B→C→I→G→H→J,最后的氢氧化钠溶液可以防止二氧化硫污染空气,故答案为:I→G→H→J;
(6)根据上述分析,检验二氧化硫的漂白性,试剂X为品红溶液。能证明SO2有还原性的实验现象为装置H中酸性KMnO4溶液褪色或变浅,故答案为:品红溶液;装置H中酸性KMnO4溶液褪色或变浅;
(7)装置G中发生反应的离子方程式为2S2-+2H2O+5SO2=3S↓+4HSO3-,故答案为:2S2-+2H2O+5SO2=3S↓+4HSO3-。

【题目】表是25℃时某些弱酸的电离平衡常数,下列说法正确的是( )
化学式 | CH3COOH | HClO | H2CO3 |
Ka | 1.8×10﹣5 | 3.0×10﹣8 | Ka1=4.1×10﹣7Ka2=5.6×10﹣11 |
A. 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是:c(Na+)>c(ClO﹣)>c(CH3COO﹣)>c(OH﹣)>c(H+)
B. 向0.1mol·L﹣1CH3COOH溶液中滴加NaOH溶液至溶液pH=5,此时:c(CH3COOH):c(CH3COO﹣)=9:5
C. 少量碳酸氢钠固体加入到新制的氯水中,c(HClO)增大
D. 等体积等物质的量浓度的CH3COONa(aq)与NaClO(aq)中离子总数大小:N前<N后
【题目】(M分)研究碳、氮及其化合物的转化对于环境的改善有重大意义。氧化还原法消除NOx的转化如下:NO![]() NO2
NO2![]() N2
N2
已知:NO(g)+O3(g)==NO2(g)+O2(g) △H=-200.9kJ·mol-1
2NO(g)+O2(g)==2NO2(g) △H=-2116.2kJ·mol-1
(1)则反应I的热化学方程式为_________________。
(2)有人设想将CO按下列反应除去:2CO(g)==2C(s)+O2(g) △H >0,你认为该设想能否实现并说明理由:_____________________。
(3)一定条件下,CO可与粉末状的氢氧化钠作用生成甲酸钠。己知常温时,甲酸的电离平衡常数Ka= l.70×10-4。向20 mL 0.1 mol/L的甲酸钠溶液中滴加10mL 0.1 mol/L的盐酸,混合液呈_____(填“酸”或“碱”)性,溶液中离子浓度从大到小的顺序为_____________。
(4)活性炭也可用于处理汽车尾气中的NO。在2 L恒容密闭容器中加入0.1000 mol NO和2.030 mol固体活性炭,生成A、B两种气体,在不同温度下测得平衡体系中各物质的物质的量如下表:
固体活性炭/mol | NO/mol | A/mol | B/mol | |
200℃ | 2.000 | 0.040 0 | 0.030 0 | 0.030 0 |
335℃ | 2.005 | 0.050 0 | 0.025 0 | 0.025 0 |
①该反应的正反应为_________(填“吸热”或“放热”)反应。
②200℃时,平衡后向恒容容器中再充入0.100 0 mol NO,再次平衡后,NO的百分含量将__________(填“增大”“减小”或“不变”)。
③计算反应体系在335℃时的平衡常数_______________。
(5)CO2的处理方法有多种,将少量CO2气体通入石灰乳中充分反应,达到平衡后,测得溶液中c(OH-)=c mol/L,则c(CO32-)=_____ mol·L-1(用含a、b、c的代数式表示)。(已知Kap(CaCO3)=a,Kap[Ca(OH)2]=b)