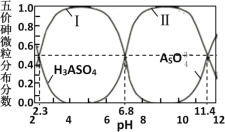
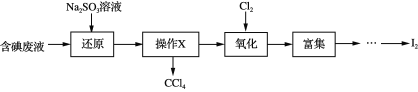
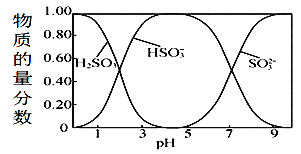
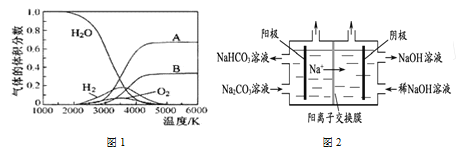
题目内容
【题目】25℃时,醋酸溶液中存在电离平衡:CH3COOH![]() CH3COO-+ H+,下列说法正确的是
CH3COO-+ H+,下列说法正确的是
A.向体系中加入少量CH3COONa固体,平衡向左移动,c(CH3COO-)下降
B.向体系中加水稀释,平衡向右移动,溶液中所有离子的浓度都减小
C.加入少量NaOH固体(忽略溶解热效应),平衡向右移动,水的电离程度也随之增大
D.升高体系温度(忽略醋酸挥发),溶液中H+数目增多,平衡一定向左移动
【答案】C
【解析】
A、向体系中加入少量CH3COONa固体,c(CH3COO-)增大,平衡向左移动,选项A错误;
B、向体系中加水稀释,平衡向右移动,溶液中c(CH3COO-)、c(H+)减小,温度不变,KW不变,根据KW= c(H+) c(OH-)可知,c(H+)减小,则c(OH-)增大,选项B错误;
C. 加入少量NaOH固体(忽略溶解热效应),c(OH-)增大,c(H+)减小,平衡向右移动,水的电离程度也随之增大,选项C正确;
D. 升高体系温度(忽略醋酸挥发),电离程度增大,平衡向右移动,溶液中H+数目增多,选项D错误。
答案选C。

练习册系列答案
 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目