题目内容
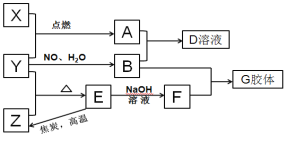
【题目】2019年4月,陨石坠落哥斯达黎加,再次引发了人们对“天外来客”的关注,下图中(部分产物已略去),X、Y、Z为单质,其它为化合物;E为陨石的主要成分,也是石英砂的主要成分;A为黑色磁性氧化物,请回答下列问题:
(1)写出E与焦炭在高温下反应制取Z的化学方程式,并用单线桥分析标明电子转移数目_____.
(2)写出E与 NaOH溶液反应的离子方程式 ______
(3)A与足量B的稀溶液反应生成D溶液,请用文字表述检验D中金属阳离子存在的一种实验方法:______
(4)已知在外加直流电作用下,G胶粒会向阳极区移动,这种现象叫做____;净化G胶体可采用图___(填序号)的方法,此种方法叫_____。

【答案】![]() SiO2 + 2OH- = SiO32-+ H2O 取少量待检液于试管,滴加KSCN溶液,若溶液变红色,则说明有Fe3+存在(或者)取少量待检液于试管,滴加KOH溶液,若有红褐色沉淀生成,则说明有Fe3+存在 电泳 ② 渗析
SiO2 + 2OH- = SiO32-+ H2O 取少量待检液于试管,滴加KSCN溶液,若溶液变红色,则说明有Fe3+存在(或者)取少量待检液于试管,滴加KOH溶液,若有红褐色沉淀生成,则说明有Fe3+存在 电泳 ② 渗析
【解析】
由于E为陨石的主要成分,也是石英砂的主要成分,因此E为SiO2;A为黑色磁性氧化物,因此A为Fe3O4,由于X、Y、Z为单质,所以X为Fe、Y为氧气、Z为Si。由此可推断出B为硝酸、D为硝酸铁溶液、F为硅酸钠溶液、G为硅酸凝胶,由此解题。
(1) SiO2与焦炭在高温下反应制取Si的化学方程式为:SiO2+2C![]() Si+2CO↑,用单线桥表示其电子转移数目为
Si+2CO↑,用单线桥表示其电子转移数目为![]() ;
;
(2) SiO2是酸性氧化物,与 NaOH溶液反应生成盐和水,其离子方程式可表示为:SiO2 + 2OH- = SiO32-+ H2O;
(3) Fe3O4与足量的稀硝酸反应生成硝酸铁溶液,因此溶液中的阳离子为Fe3+,其检验的方法为:取少量待检液于试管,滴加KSCN溶液,若溶液变红色,则说明有Fe3+存在(或者)取少量待检液于试管,滴加KOH溶液,若有红褐色沉淀生成,则说明有Fe3+存在;
(4)在外加直流电作用下,胶粒做定向移动的现象为电泳现象;净化胶体主要是洗去胶体中的离子,所以应采用渗析的方法,选择的是图②中的装置。

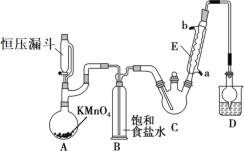
【题目】三氯乙醛(CCl3CHO)是生产农药、医药的重要中间体,实验室制备三氯乙醛的反应装置示意图(加热装置未画出)和有关数据如下:
①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
②相关物质的相对分子质量及部分物理性质:
相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | |
C2H5OH | 46 | -114.1 | 78.3 | 与水互溶 |
CCl3CHO | 147.5 | -57.5 | 97.8 | 可溶于水、乙醇 |
CCl3COOH | 163.5 | 58 | 198 | 可溶于水、乙醇、三氯乙醛 |
C2H5Cl | 64.5 | -138.7 | 12.3 | 微溶于水,可溶于乙醇 |
(1)恒压漏斗中盛放的试剂的名称是_____,盛放KMnO4仪器的名称是_____。
(2)反应过程中C2H5OH和HCl可能会生成副产物C2H5Cl,同时CCl3CHO(三氯乙醛)也能被次氯酸继续氧化生成CCl3COOH(三氯乙酸),写出三氯乙醛被次氯酸氧化生成三氯乙酸的化学方程式:_____。
(3)该设计流程中存在一处缺陷是_____,导致引起的后果是_____,装置B的作用是______。
(4)反应结束后,有人提出先将C中的混合物冷却到室温,再用分液的方法分离出三氯乙酸。你认为此方案是否可行_____(填是或否),原因是_____。
(5)测定产品纯度:称取产品0.36g配成待测溶液,加入0.1000molL1碘标准溶液20.00mL,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,立即用0.02000molL1Na2S2O3溶液滴定至终点。进行三次平行实验,测得平均消耗Na2S2O3溶液20.00mL。则产品的纯度为_____(计算结果保留四位有效数字)。滴定原理:CCl3CHO+OH-=CHCl3+HCOO-、HCOO-+I2=H++2I-+CO2、I2+2S2O32-=2I-+S4O62-








