题目内容
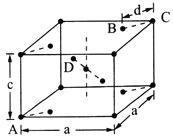
【题目】微型化学实验能有效减少污染,节约药品。下图中,某学生在衬有一张白纸的玻璃片上放置表面皿,在表面皿上的不同位置分别滴加浓度为0.1 mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,在表面皿中心处放置2小粒KMnO4晶体,并滴加一滴浓盐酸,立即将表面皿盖好。可见KMnO4晶体很快溶解,并产生气体。

(1) 完成本实验中制取Cl2的化学方程式:
__KMnO4+____HCl(浓)—___KCl +_____ MnCl2 + ____ Cl2↑+__ ______ .
如该反应中消耗还原剂的物质的量为8mol,则电子转移数目为________ .
⑵b处的实验现象为___________;c处的实验现象为____________
⑶d处反应的离子方程式为_______、_______
⑷通过该实验能比较Cl2、FeCl3、KMnO4三种物质氧化性的强弱,其氧化性由强到弱的顺序是__。
【答案】2 16 2 2 5 8 H2O 8NA b处溶液变蓝色 c处溶液红色褪色 2Fe2++ Cl2 = 2Fe3++ 2Cl- Fe3++ 3SCN- = Fe(SCN)3 KMnO4 > Cl2 > FeCl3
【解析】
高锰酸钾具有强氧化性,能把盐酸氧化生成氯气,自身被还原生成氯化锰,此反应原理为2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O。在此反应中高锰酸钾是氧化剂,盐酸是还原剂,根据高锰酸钾或参加氧化还原反应的盐酸的计量数及化合价变化可判断出转移电子的数目。产物氯气具有氧化性,且易与碱反应,由此解题。
(1)高锰酸钾具有强氧化性,能把盐酸氧化生成氯气,自身被还原生成氯化锰,所以发生的反应方程式为:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O,故其配平系数为2、16、2、2、5、8H2O;该反应中氧化剂是高锰酸钾,还原剂是盐酸,根据转移电子数守恒可知,当2mol高锰酸钾参加反应时,转移电子数目=2mol×(7-2)=10mol,此时消耗还原剂的物质的量为10mol,因此当反应中消耗还原剂的物质的量为8mol,则电子转移数目为8NA;
(2)b处氯气能置换出碘,碘遇淀粉变蓝色,c处氯气能与氢氧化钠反应生成氯化钠、次氯酸钠和水,使酚酞褪色。因此b处看到的现象是溶液变蓝色,c处看到的现象是溶液红色褪去;
(3)d处 氯气氧化氯化亚铁生成氯化铁,氯化铁和硫氰化钾溶液反应使溶液呈血红色,所以d处反应的离子方程式为2Fe2++ Cl2 = 2Fe3++ 2Cl- 、 Fe3++ 3SCN-= Fe(SCN)3;
(4)2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O中氧化性KMnO4>Cl2,2FeCl2+Cl2=2FeCl3中氧化性Cl2>FeCl2,所以氧化性大小顺序是KMnO4>Cl2>FeCl3。

 灵星计算小达人系列答案
灵星计算小达人系列答案