题目内容
( 8分)将物质的量均为3.00mol物质A、B混合于5L容器中,发生如下反应 3A+B 2C,在反应过程中C的物质的量分数随温度变化如图所示:
2C,在反应过程中C的物质的量分数随温度变化如图所示:
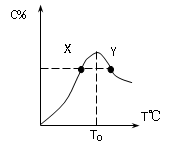
T0对应的反应速率V正和V逆的关系是_____(用含“>”“<”“=”表示,下同);
(2) 此反应的正反应为______热反应;
(3) X、Y两点A物质正反应速率的大小关系是______________;
(4) 温度T<T0时,C%逐渐增大的原因是________________________;
(5) 若Y点的C的物质的量分数为25%,则参加反应的A的物质的量为_______;若Y点时所耗时间为2min,则B物质的反应速率为__________。
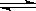 2C,在反应过程中C的物质的量分数随温度变化如图所示:
2C,在反应过程中C的物质的量分数随温度变化如图所示:
T0对应的反应速率V正和V逆的关系是_____(用含“>”“<”“=”表示,下同);
(2) 此反应的正反应为______热反应;
(3) X、Y两点A物质正反应速率的大小关系是______________;
(4) 温度T<T0时,C%逐渐增大的原因是________________________;
(5) 若Y点的C的物质的量分数为25%,则参加反应的A的物质的量为_______;若Y点时所耗时间为2min,则B物质的反应速率为__________。
(1)V正=V逆 (1分) (2)放热反应;(1分) (3)Y>X;(1分)
(4)反应未达到平衡,反应仍在向正反应方向进行,故C%的逐渐增大。(1分)
(5)1.8mol;(2分)0.06mol/L·min(2分)
(4)反应未达到平衡,反应仍在向正反应方向进行,故C%的逐渐增大。(1分)
(5)1.8mol;(2分)0.06mol/L·min(2分)
由图可知,曲线上的最高点为化学反应所能达到的最大限度即达到平衡状态。所以(1)T0对应的反应速率V正和V逆的关系是V正=V逆
(2)当可逆反应达到平衡后即T0时,再升高温度C%是减小的,说明该反应的正反应为放热反应;
(3)化学反应速率随温度的升高而增大,固X、Y两点A物质正反应速率的大小关系是Y>X
(4)温度T<T0时,C%逐渐增大的原因是,此时反应未达到平衡状态,此时V正>V逆,反应向正反应方向进行。
(5)设在反应过程中B的物质的量变化为x;
根据化学反应方程式3A + B 2C
2C
起始物质的量 3mol 3mol 0
变化物质的量 3x x 2x
反应后物质的量 3-3x 3-x 2x
即可得: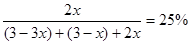 ;
;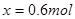
所以求得正确答案。
(2)当可逆反应达到平衡后即T0时,再升高温度C%是减小的,说明该反应的正反应为放热反应;
(3)化学反应速率随温度的升高而增大,固X、Y两点A物质正反应速率的大小关系是Y>X
(4)温度T<T0时,C%逐渐增大的原因是,此时反应未达到平衡状态,此时V正>V逆,反应向正反应方向进行。
(5)设在反应过程中B的物质的量变化为x;
根据化学反应方程式3A + B
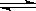 2C
2C起始物质的量 3mol 3mol 0
变化物质的量 3x x 2x
反应后物质的量 3-3x 3-x 2x
即可得:
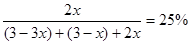 ;
;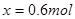
所以求得正确答案。

练习册系列答案
 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案
相关题目
 2NH3(g);在2 min时达到平衡状态,此时c(N2)=5.00 mol·L-1,c(H2)=10.00 mol·L-1,c(NH3)=5.00 mol·L-1。
2NH3(g);在2 min时达到平衡状态,此时c(N2)=5.00 mol·L-1,c(H2)=10.00 mol·L-1,c(NH3)=5.00 mol·L-1。 4NO(g) + 6H2O(g) 在5L密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则此反应的平均速率x
4NO(g) + 6H2O(g) 在5L密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则此反应的平均速率x . (NH3) =" 0.008mol·(L·s)" –1
. (NH3) =" 0.008mol·(L·s)" –1 4C(g)+5D(g)在2L的密闭容器中进行,1min后A气体减少了0.12mol,则平均每秒中浓度变化正确的是
4C(g)+5D(g)在2L的密闭容器中进行,1min后A气体减少了0.12mol,则平均每秒中浓度变化正确的是
 .0.025 mol/(L·s) B.0.125mol/(L·s) C.0.05 mol/(L·s) D.0.1 mol/(L·s)
.0.025 mol/(L·s) B.0.125mol/(L·s) C.0.05 mol/(L·s) D.0.1 mol/(L·s)