题目内容
将氯气通入含有12.5gNaBr的溶液中,反应后将溶液加热蒸干得到8.05g固体,求反应中消耗的氯气质量。
3.55g
可由两种固体质量差为出发点进行计算,即用差量法求解。
2NaBr + Cl2 =" " 2NaCl+Br2
2×103 71 2×58.5
根据反应式的重量关系,只要有71g Cl2参与反应,必有206g NaBr转化为117g NaCl,也就是固体重量必减少(206-117)=89g,从而避开Cl2用量是否充足的问题,使计算过程简单化。
设通入的Cl2重量为x2g。
2NaBr + Cl2 =" " 2NaCl+Br2 Δm
206 71 117 206-117=89
x2 12.5-8.05=4.45
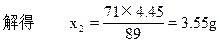
则反应中消耗的氯气重量是3.55g。
2NaBr + Cl2 =" " 2NaCl+Br2
2×103 71 2×58.5
根据反应式的重量关系,只要有71g Cl2参与反应,必有206g NaBr转化为117g NaCl,也就是固体重量必减少(206-117)=89g,从而避开Cl2用量是否充足的问题,使计算过程简单化。
设通入的Cl2重量为x2g。
2NaBr + Cl2 =" " 2NaCl+Br2 Δm
206 71 117 206-117=89
x2 12.5-8.05=4.45
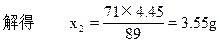
则反应中消耗的氯气重量是3.55g。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
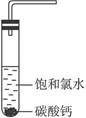
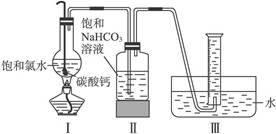
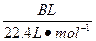 明显小于
明显小于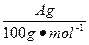 。若不考虑实验操作和CO2的溶解等因素造成的误差,从化学反应原理来看,导致这一大小关系的原因是____________________________________________。
。若不考虑实验操作和CO2的溶解等因素造成的误差,从化学反应原理来看,导致这一大小关系的原因是____________________________________________。