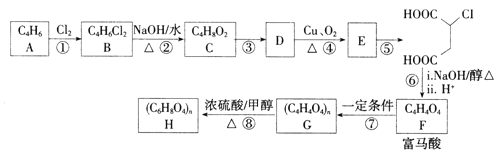
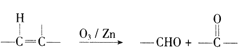题目内容
【题目】NA为阿伏加德罗常数的值,下列说法正确的是
A. 过氧化钠与水反应生成0.1mol氧气时,转移的电子数为0.2NA
B. 常温下,56g铁片投入足量浓H2SO4中生成NA个SO2分子
C. 相同质量的铝,分别与足量的盐酸和氢氧化钠溶液反应放出的氢气体积一定不相同
D. 标准状况下,11.2L N2和O2的混合气体中所含的原子数为2NA
【答案】A
【解析】A.过氧化钠与水反应时,氧元素的价态一半由-1价变为0价,一半降为-2价;B、常温下,铁在浓硫酸中会钝化;C.根据铝与氢氧化钠溶液和稀盐酸反应的化学方程式分析判断;D. 先计算标准状况下11.2L N2和O2的混合气体的物质的量,再判断。
A.过氧化钠与水反应时,氧元素的价态由-1价变为0价,一半降为-2价,故当生成0.1mol氧气时转移0.2mol电子即0.2NA个,故A正确;B、铁在浓硫酸中会钝化,故铁不能完全反应,则生成的二氧化硫分子小于NA个,故B错误;C.由2Al+6HCl=2AlCl3+3H2↑、2Al+2H2O+2NaOH=2NaAlO2+3H2↑可知,当酸、碱均过量,铝完全反应,铝的物质的量相等,转移电子数相等,生成氢气的物质的量相等,故C错误;D. 标准状况下,11.2L N2和O2的混合气体的物质的量为![]() =0.5mol,所含的原子数为NA,故D错误;故选A。
=0.5mol,所含的原子数为NA,故D错误;故选A。

【题目】(1)用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如下:

c电极的反应方程式为:__________________________。
(2)有机物C4H10与氯气发生取代反应,生成的一氯代物有_______种。
(3) 已知反应H2(g)+Br2(l)2HBr(g)在25 ℃、101 kPa下进行,放出热量为72 kJ,蒸发1 mol Br2(l)需要吸收的能量为30 kJ,其他相关数据如下表:
H2(g) | Br2(g) | HBr(g) | |
1 mol分子中的化学键断裂时需要吸收的能量/kJ | 436 | a | 369 |
则表中a为(_____________)
(4) 元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。

一定条件,在水溶液中1 mol Cl-、ClOX-(x=1,2,3,4)的能量(KJ)相对大小如上图所示。
①D是__________(填离子符号)。
②B→A+C反应的离子方程式为__________________;