题目内容
【题目】将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如下图所示。下列说法正确的是 ( )
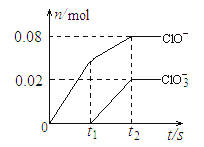
A. 苛性钾溶液中KOH的质量是5.6 g B. 反应中转移电子的物质的量是0.18mol
C. 在酸性条件下 ClO- 和ClO3-可生成Cl2 D. 一定有3.136 L氯气参与反应
【答案】B
【解析】氯气和氢氧化钾溶液反应生成次氯酸钾、氯化钾和氯酸钾,根据图象知n(ClO-)=0.08mol,n(ClO3-)=0.02mol,根据得失电子守恒可知生成的氯离子n(Cl-)=0.08mol×(1-0)+0.02mol×(5-0)=0.18mol,且转移电子物质的量为0.18mol,根据物料守恒可知n(K+)=n(Cl-)+n(ClO-)+n(ClO3-)=0.18mol+0.08mol+0.02mol=0.28mol。
A、通过以上分析可知,氢氧化钾的物质的量是0.28mol,质量是0.28mol×56g/mol=15.68g,故A错误;
B、根据上述分析可知,反应中转移电子的物质的量是0.18mol,故B正确;
C、因ClO-中Cl元素的化合价是+1价,ClO3-中Cl元素的化合价是+5价,而Cl2中Cl元素的化合价是0价,所以ClO- 和ClO3-中Cl元素的化合价都比Cl2中Cl元素的化合价高,故ClO- 和ClO3-不可能生成Cl2,所以C错误;
D、因n(Cl-)+n(ClO-)+n(ClO3-)=0.18mol+0.08mol+0.02mol=0.28mol,则根据原子守恒可知Cl2的物质的量是0.14mol,但题目未说明是标准状况,所以无法计算Cl2的体积,故D错误;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】二氧化锆是重要的耐高温材料、陶瓷绝缘材料.以锆英砂(主要成分为ZrSiO4 , 还含有少量Fe2O3、Al2O3、SiO2等杂货)为原料制备二氧化锆(ZrO2)的工艺流程如图所示. 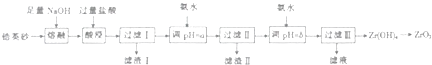 已知:①ZrO2能与烧碱反应生成可溶于水的Na2ZrO2 , Na2ZrO2与酸反应生成ZrO2+
已知:①ZrO2能与烧碱反应生成可溶于水的Na2ZrO2 , Na2ZrO2与酸反应生成ZrO2+
②部分离子在实验条件下开始沉淀和完全沉淀时的pH如下表
离子 | Fe3+ | AP+ | ZrO2+ |
开始沉淀pH | 1.9 | 3.3 | 6.2 |
完仝沉淀pH | 3.2 | 5.2 | 8.0 |
(1)经熔融后,锆英砂中Zr元素以(写化学式)形式存在,写出酸浸时生成Al3+、Fe3+的离子方程式:
(2)滤渣I的主要成分的名称为
(3)向过滤Ⅰ所得溶液中加氨水调pH=a,其目的是然后继续加氨水至pH=b的范围是
(4)向过滤Ⅲ所得溶液中加入CaCO2粉末并加热,可得CO2和另一种气体,该反应的离子方程式为